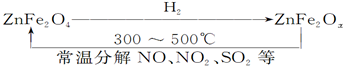题目内容
20. 有一透明溶液,可能含有较大量的NH4+、Fe3+、Na+、SO42-、CO32-、H+、Mg2+、Al3+、Cu2+中的某一种或几种,取此溶液做下列试验
有一透明溶液,可能含有较大量的NH4+、Fe3+、Na+、SO42-、CO32-、H+、Mg2+、Al3+、Cu2+中的某一种或几种,取此溶液做下列试验a.取少量溶液,加入用盐酸酸化的氯化钡溶液,有白色沉淀生成;
b.另取少量溶液,加入过氧化钠粉末,溶液中只有白色沉淀,并逸出无色无味的气体.
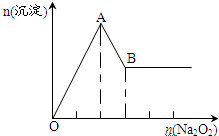
其加入过氧化钠的物质的量与析出沉淀的物质的量的关系如图:
(1)溶液中一定含有的离子为:SO42-、Al3+、Mg2+;
(2)溶液中肯定不含的离子为:H+、NH4+、CO32-、Cu2+、Fe3+;
(3)溶液中可能含有的离子为:Na+;
(4)写出过氧化钠与水反应方程式2Na2O2+2H2O═4NaOH+O2↑;
(5)写出AB段的离子方程式Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓.
分析 a.加入盐酸酸化的氯化钡产生白色沉淀,说明溶液中一定含有硫酸根离子;
b.生成的是白色沉淀,一定没有铁离子、铜离子;根据图象分析,开始生成沉淀,说明溶液中一定不存在氢离子,生成的沉淀只有部分溶解,证明溶液中一定存在铝离子、镁离子,能够与镁离子、铝离子反应的离子不能存在;
根据以上分析完成本题.
解答 解:a.取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成,白色沉淀为硫酸钡,证明溶液中一定存在硫酸根离子;
b.取少量原溶液加入过氧化钠粉末,溶液中有白色沉淀产生,氢氧化铁为红褐色、氢氧化铜为蓝色沉淀,所以溶液中一定不存在铜离子、铁离子;产生的无色无味的气体为氧气,氨气有刺激性气味,溶液中一定不会存在铵离子;根据图象可知,开始就出现沉淀生成,证明溶液中一定不存在氢离子,生成的沉淀只能部分溶解,所以溶液中一定存在铝离子和镁离子,一定不存在碳酸根离子,
(1)根据以上分析,溶液中一定存在的离子为:SO42-、Al3+、Mg2+,
故答案为:SO42-、Al3+、Mg2+;
(2)溶液中一定不存在的离子为:H+、NH4+、CO32-、Cu2+、Fe3+,
故答案为:H+、NH4+、CO32-、Cu2+、Fe3+;
(3)根据以上推断,无法确定是否含有钠离子,故答案为:Na+;
故答案为:Na+;
(4)过氧化钠与水反应生成氢氧化钠和氧气,反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(5)AB段是离子产生沉淀直到最大量的过程,反应的离子方程为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,故答案为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓.
点评 本题考查了离子检验方法,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.

 名校课堂系列答案
名校课堂系列答案| A. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| B. | 硫氢化钠水解:HS-+H2O?H3O++S2- | |
| C. | 制Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 硫酸铝溶液跟偏铝酸钠溶液反应:Al3++3AlO2-+6H2O═4Al(OH)3↓ |
| A. | 不变 | B. | 变浅 | C. | 变深 | D. | 无法确定 |
| A. | 将40g NaOH溶于1L 水所得的溶液 | |
| B. | 将0.5mol•L-1的NaNO3溶液100mL 加热蒸发掉50g水所得的溶液 | |
| C. | 将23g Na 溶于水并配成1L的溶液 | |
| D. | 含K+为2mol的K2SO4溶液 |
| A. | 137Cs和133Cs互为同位素 | B. | 单质Cs与水反应非常缓慢 | ||
| C. | 137Cs比133Cs比多个中子 | D. | 137Cs最外层只有1个电子 |
①C与O2 ②Na与O2 ③Fe与Cl2 ④AlCl3溶液与氨水 ⑤CO2与NaOH溶液.
| A. | 除③外 | B. | 除③⑤外 | C. | 除③④外 | D. | 除②外 |
图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化.下列有关说法正确的是( )
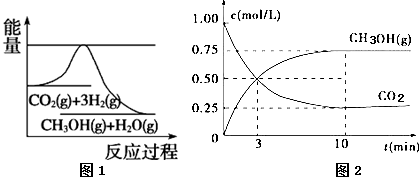
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则$\frac{n({CH}_{3}OH)}{n({CO}_{2})}$增大 | |
| C. | 温度降低,CH3OH(g)+H2O(g)?CO2(g)+3H2(g)的平衡常数K增大 | |
| D. | 从反应开始到平衡,用氢气表示的平均反应速率为0.225 mol/(L•min) |
| A. | 20mL 2mol•L-1 | B. | 10mL 5mol•L-1 | C. | 20mL 3mol•L-1 | D. | 10mL 3mol•L-1 |