题目内容
19.下列关于元素周期表的说法正确的是( )| A. | ⅠA族元素也称为碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 元素周期表中最右上角元素的非金属性最强 | |
| D. | 元素周期表有18个纵行,16个族 |
分析 A.IA族包含碱金属与氢元素;
B.氦原子核外只有2个电子;
C、最右上角元素是氦,氦为稀有气体;
D、元素周期表中共18个纵行,7个主族,7个副族,1个0族,1个第ⅤⅢ族.
解答 解:A.IA族包含碱金属与氢元素,除氢之外的其它元素属于碱金属,故A错误;
B.氦原子核外只有2个电子,其它稀有气体原子最外层电子数为8,故B错误;
C、最右上角元素是氦,氦为稀有气体,性质最稳当,故C错误;
D、素周期表中共18个纵行,7个主族,7个副族,1个0族,1个第ⅤⅢ族,共16个族,故D正确;
故选D.
点评 本题考查元素周期表与元素的性质知识,题目较为简单,注意基础知识的积累.

练习册系列答案
相关题目
9.在一定条件下,NO跟NH3可发生反应生成N2和H2O.现有一定量的NO和NH3的混合气体恰好完全反应,所得产物中还原产物比氧化产物多2.8g,则原混合气体中NO和NH3总的物质的量为( )
| A. | 0.25mol | B. | 0.5mol | C. | 1mol | D. | 2mol |
10.将8g NaOH溶解在10mL水中,再稀释成1L溶液,从中取出10mL,这10mL溶液的物质的量浓度为( )
| A. | 2 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.02mol•L-1 | D. | 20 mol•L-1 |
7.在1L的密闭容器中通入2molNH3,在一定温度下发生下列反应:2NH3?N2+3H2,达到平衡时,容器内N2的体积百分含量为a%.若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内N2的体积百分含量也为a%的是( )
| A. | 3molH2+2molN2 | B. | 4molNH3 | ||
| C. | 2molN2+6molH2 | D. | 1molNH3+0.5molN2+1.5molH2 |
11.如表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
(1)被选作相对原子质量标准的核素是12C(填核素符号).
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物是两性氧化物的元素在第ⅢA族;写出它的氧化物与氢氧化钠溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)从⑤到⑧的元素中,Na原子半径最大(填元素符号).
(5)元素④与⑥形成的化合物属于离子(填“共价”或“离子”)化合物.
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是C.
A、将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B、比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C、将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D、将⑤、⑥的单质分别在O 2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物是两性氧化物的元素在第ⅢA族;写出它的氧化物与氢氧化钠溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(4)从⑤到⑧的元素中,Na原子半径最大(填元素符号).
(5)元素④与⑥形成的化合物属于离子(填“共价”或“离子”)化合物.
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是C.
A、将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B、比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C、将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D、将⑤、⑥的单质分别在O 2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强.
6.下列转化关系不能通过一步反应直接完成的是( )
| A. | Cu→CuCl2 | B. | CuO→Cu2O | C. | Cu(OH)2→CuO | D. | CuO→Cu(OH)2 |
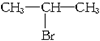 (主要产物),1mol某烃A充分燃烧后得到8mol CO2和4mol H2O.
(主要产物),1mol某烃A充分燃烧后得到8mol CO2和4mol H2O.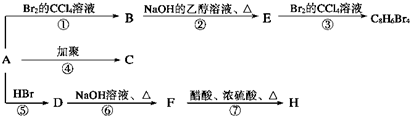
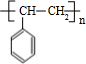
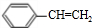 .
.
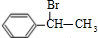 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$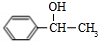 +NaBr
+NaBr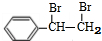 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$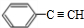 +2NaBr+2H2O.
+2NaBr+2H2O.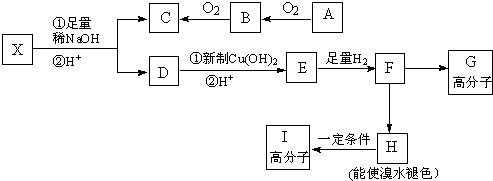
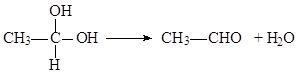
 .
.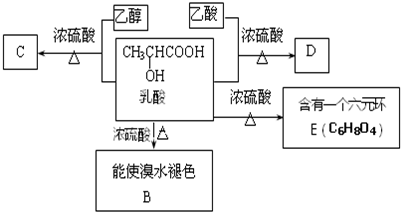
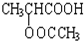 ;
;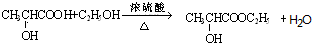 ;
;