题目内容
已知:氧化性:KMnO4>HNO3;Bi 元素+3价较稳定,NaBiO3溶液为无色.取一定量的Mn(NO3)2的酸性溶液依次进行下列实验,现象记录如下.
①滴加适量的NaBiO3溶液,溶液变为紫红色.
②继续滴加适量H2O2,紫红色褪去,并有气泡产生.
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色.
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出Bi在周期表中的位置 ;
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(3)实验④中的现象为: ;
(4)实验②反应的离子方程式是: ;
(5)实验③反应的离子方程式是: .
①滴加适量的NaBiO3溶液,溶液变为紫红色.
②继续滴加适量H2O2,紫红色褪去,并有气泡产生.
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色.
④最后通入足量的SO2气体,请回答下列问题:
(1)Bi和P元素在同一主族,试写出Bi在周期表中的位置
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为
(3)实验④中的现象为:
(4)实验②反应的离子方程式是:
(5)实验③反应的离子方程式是:
考点:元素周期律和元素周期表的综合应用,离子方程式的书写,氧化还原反应方程式的配平
专题:基本概念与基本理论
分析:(1)根据氮族元素位置确定;
(2)氧化剂的氧化性大于氧化产物的氧化性;
(3)KMnO4氧化SO2气体生成SO42-,SO42-和③中生成的Pb2+反应生成白色沉淀;
(4)双氧水可以被高锰酸根离子氧化为氧气,自身被还原为Mn2+,同时生成水,根据电子转移守恒和电荷守恒、原子守恒配平写出方程式;
(5)PbO2氧化Mn2+生成KMnO4,自身被还原为Pb2+,配平写出方程式.
(2)氧化剂的氧化性大于氧化产物的氧化性;
(3)KMnO4氧化SO2气体生成SO42-,SO42-和③中生成的Pb2+反应生成白色沉淀;
(4)双氧水可以被高锰酸根离子氧化为氧气,自身被还原为Mn2+,同时生成水,根据电子转移守恒和电荷守恒、原子守恒配平写出方程式;
(5)PbO2氧化Mn2+生成KMnO4,自身被还原为Pb2+,配平写出方程式.
解答:
解:(1)氮族元素处于ⅤA族,自上而下为N、P、As、Sb、Bi,依次为二、三、四、五、六周期,故Bi处于第6周期ⅤA族,故答案为:第6周期ⅤA族;
(2)根据氧化剂的氧化性大于氧化产物的氧化性,由①中现象可知:NaBiO3把Mn(NO3)2氧化生成KMnO4,则氧化性:NaBiO3>KMnO4;由②中现象可知:KMnO4氧化H2O2产生O2,自身被还原为Mn2+,则氧化性KMnO4>H2O2;由③中现象可知:PbO2把Mn2+氧化成KMnO4,则氧化性PbO2>KMnO4,综上所述,氧化性由强到弱的顺序是:PbO2>KMnO4>H2O2,
故答案为:PbO2>KMnO4>H2O2;
(3)反应④中KMnO4氧化SO2气体生成SO42-,SO42-和③中生成的Pb2+反应生成白色沉淀,
故答案为:溶液紫红色褪去,有白色沉淀生成;
(4)反应②是双氧水被高锰酸根离子氧化生成氧气,自身被还原为Mn2+,反应离子方程式为:5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2↑,故答案为:5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2↑;
(5)反应③是PbO2氧化Mn2+生成KMnO4,自身被还原为Pb2+,反应离子方程式为:5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O,
故答案为:5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O.
(2)根据氧化剂的氧化性大于氧化产物的氧化性,由①中现象可知:NaBiO3把Mn(NO3)2氧化生成KMnO4,则氧化性:NaBiO3>KMnO4;由②中现象可知:KMnO4氧化H2O2产生O2,自身被还原为Mn2+,则氧化性KMnO4>H2O2;由③中现象可知:PbO2把Mn2+氧化成KMnO4,则氧化性PbO2>KMnO4,综上所述,氧化性由强到弱的顺序是:PbO2>KMnO4>H2O2,
故答案为:PbO2>KMnO4>H2O2;
(3)反应④中KMnO4氧化SO2气体生成SO42-,SO42-和③中生成的Pb2+反应生成白色沉淀,
故答案为:溶液紫红色褪去,有白色沉淀生成;
(4)反应②是双氧水被高锰酸根离子氧化生成氧气,自身被还原为Mn2+,反应离子方程式为:5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2↑,故答案为:5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2↑;
(5)反应③是PbO2氧化Mn2+生成KMnO4,自身被还原为Pb2+,反应离子方程式为:5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O,
故答案为:5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O.
点评:本题考查氧化还原反应、常用化学用语,侧重考查阅读获取信息的能力,需要学生具备扎实的基础,难度中等.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
下列有关化学用语表示正确的是( )
| A、乙烯的结构简式为C2H4 |
| B、质子数为53,中子数为78的碘原子:53131I |
C、S2-的结构示意图: |
D、NH4Cl的电子式为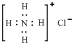 |
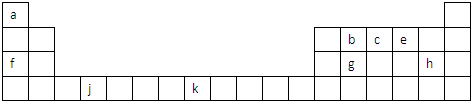
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图.下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图.下列说法正确的是( )| A、元素Y与元素Z的最高正化合价之和的数值等于9 |
| B、离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| C、原子半径的大小顺序为:rZ>rW>rQ>rX>rY |
| D、元素W的氢化物稳定性和还原性均比Q的强 |