题目内容
元素周期表中前20号元素的第一电离能如图所示.试根据元素在周期表中的位置,分析表中曲线的变化特点,并回答下列问题.
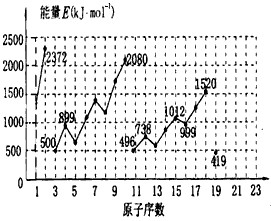
(1)同主族内不同元素的第一电离能变化 的特点是 ;各主族中第一电离能的这种变化特点体现了元素性质的 变化规律.
(2)同周期内,随原子序数增大,第一电离能增大.但个别元素的第一电离能出现反常现象,请分析其反常现象与原子结构的关系,预测下列关系式中正确的是 (填写编号)
①E(砷)>E(硒)②E(砷)<E(硒)③E(溴)>E(硒)④E(溴)<E(硒)
(3)估计Ca原子的第一电离能[用E(Ca)表示]范围: <E(Ca)<
(4)10号元素第一电离能较大的原因是 .

(1)同主族内不同元素的第一电离能变化 的特点是
(2)同周期内,随原子序数增大,第一电离能增大.但个别元素的第一电离能出现反常现象,请分析其反常现象与原子结构的关系,预测下列关系式中正确的是
①E(砷)>E(硒)②E(砷)<E(硒)③E(溴)>E(硒)④E(溴)<E(硒)
(3)估计Ca原子的第一电离能[用E(Ca)表示]范围:
(4)10号元素第一电离能较大的原因是
考点:元素周期律和元素周期表的综合应用,元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:(1)由图中数据可知,同主族自上而下第一电离能递减,体现元素性质的周期性变化规律;
(2)同周期随原子序数增大,第一电离能呈增大趋势,当各轨道级处于全满、半满、全空稳定状态时,能量较低第一电离能高于同周期相邻元素;
(3)同周期随原子序数增大,第一电离能呈增大趋势,Ca的第一电离能应高于K的,Ca比较Na活泼,其第一电离能而小于Na;
(4)10号元素各各轨道为全满稳定状态.
(2)同周期随原子序数增大,第一电离能呈增大趋势,当各轨道级处于全满、半满、全空稳定状态时,能量较低第一电离能高于同周期相邻元素;
(3)同周期随原子序数增大,第一电离能呈增大趋势,Ca的第一电离能应高于K的,Ca比较Na活泼,其第一电离能而小于Na;
(4)10号元素各各轨道为全满稳定状态.
解答:
解:(1)由图中数据可知,同主族自上而下第一电离能递减,体现元素性质的周期性变化规律,故答案为:自上而下递减;周期性;
(2)由图可知,同周期随原子序数增大,第一电离能呈增大趋势,但同周期中第一电离能ⅡA>ⅢA,ⅤA>ⅥA,即各轨道处于全满、半满、全空稳定状态时,能量较低第一电离能高于同周期相邻元素,故第一电离能:E(砷)>E(硒),E(溴)>E(硒),故答案为:①③;
(3)同周期随原子序数增大,第一电离能呈增大趋势,Ca的第一电离能应高于K的,Ca比较Na活泼,其第一电离能而小于Na,即Ca的第一电离能:419kJ/mol<E(Ca)<456kJ/mol,故答案为:419kJ/mol<E(Ca)<456kJ/mol;
(4)10号元素各轨道为全满稳定状态,难失去电子,第一电离能较大,故答案为:各轨道为全满稳定状态,难失去电子.
(2)由图可知,同周期随原子序数增大,第一电离能呈增大趋势,但同周期中第一电离能ⅡA>ⅢA,ⅤA>ⅥA,即各轨道处于全满、半满、全空稳定状态时,能量较低第一电离能高于同周期相邻元素,故第一电离能:E(砷)>E(硒),E(溴)>E(硒),故答案为:①③;
(3)同周期随原子序数增大,第一电离能呈增大趋势,Ca的第一电离能应高于K的,Ca比较Na活泼,其第一电离能而小于Na,即Ca的第一电离能:419kJ/mol<E(Ca)<456kJ/mol,故答案为:419kJ/mol<E(Ca)<456kJ/mol;
(4)10号元素各轨道为全满稳定状态,难失去电子,第一电离能较大,故答案为:各轨道为全满稳定状态,难失去电子.
点评:本题考查元素周期律,涉及第一电离能的变化趋势,难度中等,侧重考查学生读图获取信息的能力,注意理解“同一周期元素中,元素第一电离能的变化趋势及异常现象”.

练习册系列答案
相关题目
关于如图所示各装置的叙述中,正确的是( )
A、 是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
B、 通电一段时间后石墨Ⅱ电极附近溶液红褐色加深 |
C、若用 精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
D、 研究的是金属的析氢腐蚀,Fe上的反应为Fe-2e-=Fe2+ |
下列判断不合理的是( )
| A、能电离出H+的物质不一定是酸 |
| B、蔗糖、碳酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、根据分散系中分散质粒子直径大小将分散系分为溶液、胶体和浊液 |
| D、焰色反应是化学变化 |