题目内容
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)D的化学式为 .
(2)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: .
(3)写出E溶液与过量的B溶液反应的离子方程式 .
(4)分步写出E溶液中逐滴加入NaOH溶液时的离子方程式 .
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)D的化学式为
(2)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:
(3)写出E溶液与过量的B溶液反应的离子方程式
(4)分步写出E溶液中逐滴加入NaOH溶液时的离子方程式
考点:常见离子的检验方法
专题:离子反应专题
分析:①A、B两溶液呈碱性,结合离子的共存可知,应为Ba(OH)2、Na2CO3中的一种,C、D、E溶液呈酸性,应为AgNO3、硫酸铝、HCl中的一种;
②A溶液与E溶液反应既有气体又有沉淀产生,则A为Na2CO3,E为Al2(SO4)3;A溶液与C溶液反应只有气体产生,C为HCl;B为碱性,则B为Ba(OH)2;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3,然后结合物质的性质及化学用语来解答.
②A溶液与E溶液反应既有气体又有沉淀产生,则A为Na2CO3,E为Al2(SO4)3;A溶液与C溶液反应只有气体产生,C为HCl;B为碱性,则B为Ba(OH)2;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3,然后结合物质的性质及化学用语来解答.
解答:
解:①A、B两溶液呈碱性,结合离子的共存可知,应为Ba(OH)2、Na2CO3中的一种,C、D、E溶液呈酸性,应为AgNO3、硫酸铝、HCl中的一种;
②A溶液与E溶液反应既有气体又有沉淀产生,则A为Na2CO3,E为Al2(SO4)3;A溶液与C溶液反应只有气体产生,C为HCl;B为碱性,则B为Ba(OH)2;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3,
综上可知,A为Na2CO3,B为Ba(OH)2,C为HCl,D为AgNO3,E为Al2(SO4)3,
(1)由以上分析可知D为AgNO3,故答案为:AgNO3;
(2)将HCl溶液逐滴加入等体积、等物质的量浓度的Na2CO3溶液中,恰好反应生成等量的NaHCO3和NaCl,NaHCO3溶液中HCO3-水解程度大于HCO3-电离程度,且水解和电离程度都较小,主要以HCO3-形式存在,则c(HCO3-)>c(CO32-),溶液显碱性c(OH-)>c(H+),HCO3-?H++CO32-,水也电离出少量氢离子,则c(H+)>(CO32-),所以溶液中离子浓度大小关系为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)>(CO32-);
故答案为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)>(CO32-);
(3)Al2(SO4)3与过量的Ba(OH)2反应生成偏铝酸钠和硫酸钡沉淀,其反应的离子方程式为:2A13++3SO42-+3Ba2++8OH-═2A1O2-+3BaSO4↓+4H2O;
故答案为:2A13++3SO42-+3Ba2++8OH-═2A1O2-+3BaSO4↓+4H2O;
(4)在溶液Al2(SO4)3中逐步加入氢氧化钠溶液,先生成氢氧化铝沉淀,其离子方程式为:A13++3OH-═A1(OH)3↓;当氢氧化钠溶液过量时,氢氧化铝沉淀逐渐溶解生成偏铝酸钠溶液和水,其离子方程式为:A1(OH)3+OH-═A1O2-+2H2O;
故答案为:A13++3OH-═A1(OH)3↓、A1(OH)3+OH-═A1O2-+2 H2O.
②A溶液与E溶液反应既有气体又有沉淀产生,则A为Na2CO3,E为Al2(SO4)3;A溶液与C溶液反应只有气体产生,C为HCl;B为碱性,则B为Ba(OH)2;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀,则D为AgNO3,
综上可知,A为Na2CO3,B为Ba(OH)2,C为HCl,D为AgNO3,E为Al2(SO4)3,
(1)由以上分析可知D为AgNO3,故答案为:AgNO3;
(2)将HCl溶液逐滴加入等体积、等物质的量浓度的Na2CO3溶液中,恰好反应生成等量的NaHCO3和NaCl,NaHCO3溶液中HCO3-水解程度大于HCO3-电离程度,且水解和电离程度都较小,主要以HCO3-形式存在,则c(HCO3-)>c(CO32-),溶液显碱性c(OH-)>c(H+),HCO3-?H++CO32-,水也电离出少量氢离子,则c(H+)>(CO32-),所以溶液中离子浓度大小关系为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)>(CO32-);
故答案为:c(Na+)>c(C1-)>c(HCO3-)>c(OH-)>c(H+)>(CO32-);
(3)Al2(SO4)3与过量的Ba(OH)2反应生成偏铝酸钠和硫酸钡沉淀,其反应的离子方程式为:2A13++3SO42-+3Ba2++8OH-═2A1O2-+3BaSO4↓+4H2O;
故答案为:2A13++3SO42-+3Ba2++8OH-═2A1O2-+3BaSO4↓+4H2O;
(4)在溶液Al2(SO4)3中逐步加入氢氧化钠溶液,先生成氢氧化铝沉淀,其离子方程式为:A13++3OH-═A1(OH)3↓;当氢氧化钠溶液过量时,氢氧化铝沉淀逐渐溶解生成偏铝酸钠溶液和水,其离子方程式为:A1(OH)3+OH-═A1O2-+2H2O;
故答案为:A13++3OH-═A1(OH)3↓、A1(OH)3+OH-═A1O2-+2 H2O.
点评:本题考查知识点较多,侧重于学生的分析能力的考查,根据离子的共存、离子的性质来推断物质是解答本题的关键,综合性强,难度较大,学生需熟悉水解、离子反应等知识.

练习册系列答案
相关题目
氨氧化制硝酸,吸收塔内发生反应 3NO2(g)+H2O(l)?2HNO3(aq)+NO△H<0 要提高反应的转化率,增加浓硝酸的产量,应采取的措施( )
| A、加压 | B、加大水量 |
| C、升温 | D、减压 |
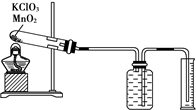 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.实验步骤如下:
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.实验步骤如下: