题目内容
如图是元素周期表的一部分,表中所列字母分别代表一种元素.
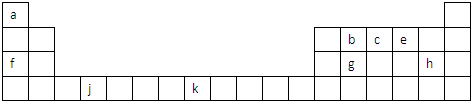
试回答下列问题:
(1)以上元素中,属于d区元素的是 (填元素符号),h在周期表的位置是 ,元素k的基态原子电子排布式为 .
(2)画出c的核外电子排布图: ,这样排布遵循了构造原理、 原理和 规则.
(3)元素b的电负性 元素g的电负性(填“>”、“=”、“<”),元素b、c、e的第一电离能由大到小的顺序是 (用元素符号表示);第三周期元素最高价氧化物对应的水化物中,酸性最强的是 (填化合物的化学式,下同),碱性最强的是 .
(4)由b原子跟g原子以1:1相互交替结合而形成的晶体,其晶型与晶体g相同.两者相比熔点更高的是 (填化学式),1 mol该晶体中含有 mol b-g共价键.

试回答下列问题:
(1)以上元素中,属于d区元素的是
(2)画出c的核外电子排布图:
(3)元素b的电负性
(4)由b原子跟g原子以1:1相互交替结合而形成的晶体,其晶型与晶体g相同.两者相比熔点更高的是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知a为H、b为C、c为N、e为O、f为Na、g为Si、h为Cl、j为Ti、k为Fe.
(1)d区元素包含ⅢB族~ⅦB族、第Ⅷ族元素,即3~10列元素(镧系元素、锕系元素除外);根据h的位置确定在周期表中位置;根据能量最低原理书写Fe元素基态原子电子排布式;
(2)c的核外电子排布式为1s22s22p3,遵循构造原理、泡利原理与洪特规则;
(3)同主族自上而下电负性减小;同周期自左而右第一电离能呈增大趋势,元素原子各轨道处于半满、全满、全空时,能量较低,第一电离能高于同周期相邻元素;
非金属性越强,最高价含氧酸的酸性越强,金属性越强,最高氧化物对应水化物的碱性越强;
(4)由b原子跟g原子以1:1相互交替结合而形成SiC晶体,其晶型与晶体Si相同,都属于原子晶体,键长越短,共价键越稳定,熔点越高;晶体中每个Si原子与周围的4个C原子形成4个Si-C键.
(1)d区元素包含ⅢB族~ⅦB族、第Ⅷ族元素,即3~10列元素(镧系元素、锕系元素除外);根据h的位置确定在周期表中位置;根据能量最低原理书写Fe元素基态原子电子排布式;
(2)c的核外电子排布式为1s22s22p3,遵循构造原理、泡利原理与洪特规则;
(3)同主族自上而下电负性减小;同周期自左而右第一电离能呈增大趋势,元素原子各轨道处于半满、全满、全空时,能量较低,第一电离能高于同周期相邻元素;
非金属性越强,最高价含氧酸的酸性越强,金属性越强,最高氧化物对应水化物的碱性越强;
(4)由b原子跟g原子以1:1相互交替结合而形成SiC晶体,其晶型与晶体Si相同,都属于原子晶体,键长越短,共价键越稳定,熔点越高;晶体中每个Si原子与周围的4个C原子形成4个Si-C键.
解答:
解:由元素在周期表中位置,可知a为H、b为C、c为N、e为O、f为Na、g为Si、h为Cl、j为Ti、k为Fe.
(1)d区元素包含ⅢB族~ⅦB族、第Ⅷ族元素,即3~10列元素(镧系元素、锕系元素除外),上述元素中Ti、Fe属于d区元素;根据h的位置,可知其处于第三周期第ⅦA族;Fe元素基态原子电子排布式为:1s22s22p63s23p63d64s2,
故答案为:Ti、Fe;第三周期第ⅦA族;1s22s22p63s23p63d64s2;
(2)c的核外电子排布式为1s22s22p3,核外电子排布图: ,遵循构造原理、泡利原理与洪特规则,
,遵循构造原理、泡利原理与洪特规则,
故答案为: ;泡利;洪特;
;泡利;洪特;
(3)同主族自上而下电负性减小,故电负性C>Si;同周期自左而右第一电离能呈增大趋势,N元素原子2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
第三周期元素中Cl的非金属性最强,Na的金属性最强,最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是 NaOH,
故答案为:>;N>O>C;HClO4;NaOH;
非金属性越强,最高价含氧酸的酸性越强,金属性越强,最高氧化物对应水化物的碱性越强;
(4)由b原子跟g原子以1:1相互交替结合而形成SiC晶体,其晶型与晶体Si相同,都属于原子晶体,键长:Si-C键<Si-Si键,故Si-C键更稳定,熔点SiC>晶体Si,晶体中每个Si原子与周围的4个C原子形成4个Si-C键,故1 mol该晶体中含有4mol Si-C共价键,
故答案为:SiC;4.
(1)d区元素包含ⅢB族~ⅦB族、第Ⅷ族元素,即3~10列元素(镧系元素、锕系元素除外),上述元素中Ti、Fe属于d区元素;根据h的位置,可知其处于第三周期第ⅦA族;Fe元素基态原子电子排布式为:1s22s22p63s23p63d64s2,
故答案为:Ti、Fe;第三周期第ⅦA族;1s22s22p63s23p63d64s2;
(2)c的核外电子排布式为1s22s22p3,核外电子排布图:
 ,遵循构造原理、泡利原理与洪特规则,
,遵循构造原理、泡利原理与洪特规则,故答案为:
 ;泡利;洪特;
;泡利;洪特;(3)同主族自上而下电负性减小,故电负性C>Si;同周期自左而右第一电离能呈增大趋势,N元素原子2p轨道容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
第三周期元素中Cl的非金属性最强,Na的金属性最强,最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是 NaOH,
故答案为:>;N>O>C;HClO4;NaOH;
非金属性越强,最高价含氧酸的酸性越强,金属性越强,最高氧化物对应水化物的碱性越强;
(4)由b原子跟g原子以1:1相互交替结合而形成SiC晶体,其晶型与晶体Si相同,都属于原子晶体,键长:Si-C键<Si-Si键,故Si-C键更稳定,熔点SiC>晶体Si,晶体中每个Si原子与周围的4个C原子形成4个Si-C键,故1 mol该晶体中含有4mol Si-C共价键,
故答案为:SiC;4.
点评:本题是对物质结构的考查,涉及元素周期表、核外电子排布、电负性、电离能、晶体类型与性质、晶体结构等,侧重对主干知识的考查,需要学生具备扎实的基础,理解同周期中第一电离能异常原因,难度中等.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
氨能跟氧气在铂催化下反应生成硝酸和水,其中第一步反应为:4NH3+5O2═4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(H2O)[mol?L-1?min-1]表示,则正确的关系是( )
| A、4v(NH3)=5v(O2) |
| B、5v(O2)=6v(H2O) |
| C、2v(NH3)=3v(H2O) |
| D、4v(O2)=5v(NO) |
下列化学用语书写正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、丙烯的键线式: |
C、CH4分子的比例模型: |
D、乙醇的结构式: |
 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.实验步骤如下:
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.实验步骤如下: