题目内容
10.苯和乙烯是来自石油和煤的两种基本化工原料,请回答下列问题:①要除去甲烷中混有的少量乙烯,相关的化学反应方程式是CH2=CH2+Br2═CH2BrCH2Br,反应类型为加成反应,所得产物的名称是1,2-二溴乙烷.
②聚乙烯塑料常用于制作食品包装袋,写出合成聚乙烯塑料的化学方程式
 .
.
分析 ①甲烷不能和溴水发生反应,乙烯可以与溴水发生加成反应生成CH2BrCH2Br;
②在一定条件下,乙烯发生加成聚合反应生成聚乙烯.
解答 解:①甲烷不能和溴水发生反应,乙烯可以与溴水发生加成反应,因此要除去甲烷中混有的少量乙烯可选用溴水,乙烯可以与溴水发生加成反应的化学方程式为CH2=CH2+Br2═CH2BrCH2Br,产物的名称是1,2-二溴乙烷,
故答案为:CH2=CH2+Br2═CH2BrCH2Br;加成反应;1,2-二溴乙烷;
②在一定条件下,乙烯发生加成聚合反应生成聚乙烯,化学方程式为 ,
,
故答案为: .
.
点评 本题考查了烷烃和烯烃的结构和性质,难度不大,侧重于烷烃和烯烃性质的差异、有机反应类型和有机物的命名,注意甲烷和乙烯的鉴别、除杂是不一样的.

练习册系列答案
相关题目
20.下列关于有机物的说法正确的是( )
| A. | 乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| B. | CH≡CH和CH2=CHCH=CH2互为同系物 | |
| C. | 乙酸乙酯在碱性条件下的水解反应皂化反应 | |
| D. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 |
18.下列属于氧化还原反应的是( )
| A. | NaOH+HCl═NaCL+H2O | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 2Na+Cl2═2NaCl | D. | AgNO3+KBr═AgBr↓+KNO3 |
5.Na2S2O3可用作照相的定影剂等.已知Na2S2O3的某些性质如下:
(Ⅰ)S2O32-能被I2氧化为S4O62-;
(Ⅱ)酸性条件下S2O32-迅速分解为S和SO2;
(Ⅲ)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品中常含有少量Na2SO3和Na2SO4.
实验室可用如下装置(略去部分夹持仪器)模仿生成过程.
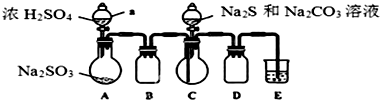
实验步骤:(1)仪器组装完成后,关闭A、C中分液漏斗活塞,将E中导管伸入盛水的水槽中,微热A中圆底烧瓶,E中导管口有气泡冒出,停止加热,导管中回流一段稳定的水柱,则整个装置气密性良好.装置D的作用是防止倒吸,装
置E中溶液的作用是吸收多余的SO2.
(2)先向C中烧瓶加入Na2CO3和Na2S混合溶液,再向A中烧瓶滴加浓H2SO4.
(3)等Na2CO3和Na2S完全消耗后,结束反应.过滤C中混合物,将溶液蒸发、结晶、过滤、洗涤、干燥,得到产品.
(4)为验证产品中含有硫酸盐,该小组设计了以下实验方案,请将方案补充完整.
(5)利用KMnO4标准溶液可以定量测定硫代硫酸钠试剂的纯度,步骤为:
①溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL.
②滴定:取10.00mL0.01mol•L-1KMnO4标准溶液,加硫酸酸化,再加过量KI溶液.写出该反应的离子反应:2MnO4-+16H++10I-═5I2+2Mn2++8H2O
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32-+I2═S4O62-+2I-),记录Na2S2O3溶液用量,滴定3次.指示剂最好选用淀粉溶液,本次滴定时所用的玻璃仪器除锥形瓶外,还有碱式滴定管.
④若3次滴定NaS2O3溶液的平均用量为12.00mL,则样品的纯度为65.8%.
(Ⅰ)S2O32-能被I2氧化为S4O62-;
(Ⅱ)酸性条件下S2O32-迅速分解为S和SO2;
(Ⅲ)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品中常含有少量Na2SO3和Na2SO4.
实验室可用如下装置(略去部分夹持仪器)模仿生成过程.

实验步骤:(1)仪器组装完成后,关闭A、C中分液漏斗活塞,将E中导管伸入盛水的水槽中,微热A中圆底烧瓶,E中导管口有气泡冒出,停止加热,导管中回流一段稳定的水柱,则整个装置气密性良好.装置D的作用是防止倒吸,装
置E中溶液的作用是吸收多余的SO2.
(2)先向C中烧瓶加入Na2CO3和Na2S混合溶液,再向A中烧瓶滴加浓H2SO4.
(3)等Na2CO3和Na2S完全消耗后,结束反应.过滤C中混合物,将溶液蒸发、结晶、过滤、洗涤、干燥,得到产品.
(4)为验证产品中含有硫酸盐,该小组设计了以下实验方案,请将方案补充完整.
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2:加入过量盐酸 | |
| 步骤3:静置后取上清液,加入BaCl2溶液 |
①溶液配制:称取1.0g Na2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL.
②滴定:取10.00mL0.01mol•L-1KMnO4标准溶液,加硫酸酸化,再加过量KI溶液.写出该反应的离子反应:2MnO4-+16H++10I-═5I2+2Mn2++8H2O
③往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32-+I2═S4O62-+2I-),记录Na2S2O3溶液用量,滴定3次.指示剂最好选用淀粉溶液,本次滴定时所用的玻璃仪器除锥形瓶外,还有碱式滴定管.
④若3次滴定NaS2O3溶液的平均用量为12.00mL,则样品的纯度为65.8%.
15.下列化学用语正确的是( )
①CO2的比例模型:
②乙酸的分子式:CH3COOH
③HClO的电子式:
④葡萄糖的实验式:CH2O
⑤聚乙烯的结构简式:
⑥Na+的结构示意图
①CO2的比例模型:

②乙酸的分子式:CH3COOH
③HClO的电子式:

④葡萄糖的实验式:CH2O
⑤聚乙烯的结构简式:

⑥Na+的结构示意图

| A. | ④⑤⑥ | B. | ①②④ | C. | ②③⑥ | D. | ③⑤⑥ |
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 64gCaC2晶体中阴离子数目是2NA | |
| B. | 36g冰晶体中氢键数目是4NA | |
| C. | pH=13的NaOH溶液中阴阳离子总数目为0.2NA | |
| D. | 1L0.1mol•L-1FeCl3溶液中Fe3+水解产生的H+数目为0.3NA |
19.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1.8g水所含有的电子数目为NA | |
| B. | 等物质的量的CaCO3和KHCO3的质量均为100g | |
| C. | 11.2L氧气所含分子数目为0.5NA | |
| D. | 200mL 0.5mol/L Na2SO4溶液所含Na+数目0.1NA |
 如图是实验室中制备气体或验证气体性质的装置图.回答下列问题:
如图是实验室中制备气体或验证气体性质的装置图.回答下列问题: