题目内容
2.NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 64gCaC2晶体中阴离子数目是2NA | |
| B. | 36g冰晶体中氢键数目是4NA | |
| C. | pH=13的NaOH溶液中阴阳离子总数目为0.2NA | |
| D. | 1L0.1mol•L-1FeCl3溶液中Fe3+水解产生的H+数目为0.3NA |
分析 A、求出CaC2的物质的量,然后根据1molCaC2中含1mol阴离子C22-来分析;
B、求出冰的物质的量,然后根据1mol冰中含2mol氢键来分析;
C、溶液体积不明确;
D、铁离子是弱碱阳离子,在溶液中会水解,但水解程度不大.
解答 解:A、64gCaC2的物质的量为1mol,而1molCaC2中含1mol阴离子C22-,即含NA个阴离子,故A错误;
B、36g冰的物质的量为2mol,而1mol冰中含2mol氢键,故2mol冰中含4mol氢键即4NA个,故B正确;
C、溶液体积不明确,故溶液中的离子的个数无法计算,故C错误;
D、铁离子是弱碱阳离子,在溶液中会水解,但水解程度不大,即铁离子不能完全水解,则水解产生的氢离子的个数小于0.3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
12.二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料,下列说法正确的是( )
| A. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| B. | 玛瑙和红宝石的主要成分都是SiO2,SiO2和Si都是制造半导体的材料 | |
| C. | 高温下SiO2能与Na2CO3反应放出CO2,说明H2SiO3的酸性强于H2CO3 | |
| D. | Na2SiO3溶液中加入盐酸可制备硅酸胶体 |
13.下列有机物命名正确的是( )
| A. | 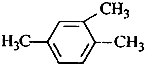 1,3,4-三甲苯 1,3,4-三甲苯 | |
| B. | 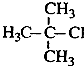 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | |
| C. | 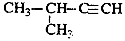 2-甲基-3-丁炔 2-甲基-3-丁炔 | |
| D. | CH3CH2C(CH3)2CH(C2H5)CH3 3,3,4-三甲基已烷 |
17.下列各组离子在常温下一定能大量共存的是( )
| A. | pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ | |
| B. | 含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+ | |
| C. | 加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- |
11.两烧杯中分别盛有100mL3mol/L的硫酸溶液或100mL3mol/L的氢氧化钠溶液(先后顺序不确定),向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为3:4,下列说法正确的是( )
| A. | 参加反应的H2SO4为0.2mol | B. | 参加反应的NaOH约为0.27mol | ||
| C. | 加入铝粉的质量为5.4g | D. | 与硫酸反应的铝粉的质量7.2g |
12.下列装置中,能对Fe片腐蚀起防护作用的是( )

| A. | ③④ | B. | ②⑤ | C. | ①③④ | D. | ②③④⑤ |
 .
.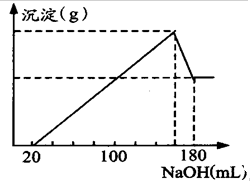 将一定质量的镁、铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液到过量,
将一定质量的镁、铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液到过量,