题目内容
15.下列化学用语正确的是( )①CO2的比例模型:

②乙酸的分子式:CH3COOH
③HClO的电子式:

④葡萄糖的实验式:CH2O
⑤聚乙烯的结构简式:

⑥Na+的结构示意图

| A. | ④⑤⑥ | B. | ①②④ | C. | ②③⑥ | D. | ③⑤⑥ |
分析 ①碳原子半径比氧原子半径大;
②乙酸的分子式为C2H4O2;
③次氯酸中O原子成2个共价键,H原子、Cl原子成1个共价键,O原子分别与H、Cl原子形成1对共用电子对;
④实验式是用元素符号表示化合物分子中元素的种类和各元素原子个数的最简整数比的式子,结合葡萄糖的分子式书写判断;
⑤乙烯通过加聚反应生成聚乙烯;
⑥钠原子失去最外层的1个电子形成钠离子,核外电子数为10,有2个电子层,各层电子数分别为2、8.
解答 解:①二氧化碳分子中,碳原子的相对体积大于氧原子,其正确的比例模型为: ,故①错误;
,故①错误;
②乙酸的分子式为C2H4O2,CH3COOH是乙酸的结构简式,故②错误;
③次氯酸中O原子成2个共价键,H原子、Cl原子成1个共价键,O原子分别与H、Cl原子形成1对共用电子对,次氯酸的电子式为 ,故③错误;
,故③错误;
④葡萄糖的分子式为C6H12O6,其实验式为CH2O,故④正确;
⑤乙烯通过加聚反应生成聚乙烯,结构简式为 ,故⑤正确;
,故⑤正确;
⑥钠原子失去最外层的1个电子形成钠离子,钠离子质子数为11,核外电子数为10,有2个电子层,各层电子数分别为2、8,结构示意图为 ,故⑥正确;
,故⑥正确;
故选A.
点评 本题考查了常见化学用语表示方法,题目难度中等,注意掌握比例模型、结构简式、实验式、离子结构示意图等化学用语的概念及表示方法,明确比例模型与球棍模型、结构式与结构简式、实验式的区别为解答关键,试题培养了学生规范答题的能力.

练习册系列答案
相关题目
6.下列说法正确的是( )
| A. | 现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| B. | 把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol•L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算 | |
| C. | 将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L.反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol | |
| D. |  某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+ 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+ |
3.常温下浓度均为0.1mol/L的四种盐溶液,其pH如表所示,下列说法正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
| A. | 将等浓度的CH3COOH和HClO溶液,pH小的是HClO | |
| B. | Na2CO3和NaHCO3溶液中粒子种类不同 | |
| C. | 溶液水的电离程度①>②>④>③ | |
| D. | NaHCO3溶液中,c(Na +)=c(CO3 2-)+c(HCO3-)+c(H2CO3) |
20.北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知:
CO:2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ/mol.
丙烷:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l);△H=-2221.5kJ/mol.
正丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l);△H=-2878.0kJ/mol.
异丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l);△H=-2869.6kJ/mol.
下列有关说法正确的是( )
CO:2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ/mol.
丙烷:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l);△H=-2221.5kJ/mol.
正丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l);△H=-2878.0kJ/mol.
异丁烷:C4H10(g)+6.5O2(g)═4CO2(g)+5H2O(l);△H=-2869.6kJ/mol.
下列有关说法正确的是( )
| A. | 常温下,正丁烷的燃烧热为-2878.0kJ/mol | |
| B. | 相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气少产生的热量也多 | |
| C. | 常温下,CO的燃烧热为283.0 kJ/mol | |
| D. | 人类利用的能源都是通过化学反应获得的 |
4.下列变化属于还原反应的是( )
| A. | Fe→FeSO4 | B. | AgNO3→Ag | C. | S→SO2 | D. | CO32-→CO2 |
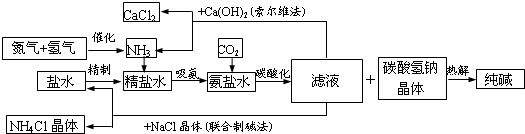
 .
.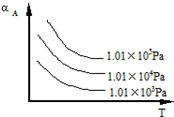 在一密闭容器中加入A、B进行可逆反应:A(g)+B(g)?m C(g)(m为整数),A的转化率(αA)与温度(T)、压强的关系如图所示:
在一密闭容器中加入A、B进行可逆反应:A(g)+B(g)?m C(g)(m为整数),A的转化率(αA)与温度(T)、压强的关系如图所示: