题目内容
20.某K2CO3与KHCO3的混合物共6.14g,加热分解后质量减少为5.52g.(1)求原混合物中K2CO3的质量分数.(写出计算过程,计算结果精确到0.1%)
(2)若将原混合物溶于200mL水配成溶液,向溶液中逐滴加入1.0mol•L-1的稀盐酸.当加入的稀盐酸的体积为30mL时开始产生气体;当加入50mL稀盐酸时,产生的气体在标准状况下的体积为448mL.
分析 (1)设原混合物中,n(K2CO3)=x mol,n(KHCO3)=y mol,根据2KHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+H2O+CO2↑,加热分解后得到共(x+0.5y)mol的K2CO3,然后利用质量守恒列式计算出碳酸钾的物质的量,再根据m=nM计算出碳酸钾的质量,最后根据质量分数的表达式计算出混合物中碳酸钾的质量分数;
(2)向溶液中逐滴加入1.0mol•L-1的稀盐酸,先发生反应K2CO3+HCl═KHCO3+KCl,然后发生反应KHCO3+HCl═KCl+H2O+CO2↑,据此列式计算.
解答 解:(1)设原混合物中,n(K2CO3)=x mol,n(KHCO3)=y mol,
根据2KHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+H2O+CO2↑,加热分解后得到共(x+0.5y)mol的K2CO3,
则:138 x+100 y=6.14、138(x+0.5y)=5.52,
解得:x=0.03,y=0.02
原混合物中K2CO3的质量分数为:ω(K2CO3)=$\frac{0.03mol×138g•mol-1}{6.14g}$×100%=67.4%,
答:原混合物中K2CO3的质量分数为67.4%;
(2)原混合物中含有0.03mol碳酸钾、0.02mol碳酸氢钾,向该溶液中逐滴加入1.0mol•L-1的稀盐酸,先发生反应K2CO3+HCl═KHCO3+KCl,0.03mol碳酸钾完全转化成碳酸氢钾总共消耗0.03molHCl,消耗盐酸溶液体积为:$\frac{0.03mol}{1.0mol/L}$=0.03L=30mL;
之后再加入盐酸后开始生成沉淀,则加入50mL稀盐酸时,与碳酸氢钾反应生成二氧化碳的盐酸为20mL,含有HCl的物质的量为:1.0mol/L×0.02L=0.02mol,根据反应KHCO3+HCl═KCl+H2O+CO2↑可知,0.02molHCl完全反应生成了0.02mol二氧化碳,标准状况下0.02mol二氧化碳的体积为:22.4L/mol×0.02mol=0.448L=448mL,
故答案为:30;448.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.

| A. | 参加反应的H2SO4为0.2mol | B. | 参加反应的NaOH约为0.27mol | ||
| C. | 加入铝粉的质量为5.4g | D. | 与硫酸反应的铝粉的质量7.2g |
 某有机物结构如图所示,一分子该物质与一分子溴发生加成反应的产物(不考虑顺反异构)理该上最多有( )
某有机物结构如图所示,一分子该物质与一分子溴发生加成反应的产物(不考虑顺反异构)理该上最多有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
(1)已知25℃时:N2(g)+O2(g)?2NO(g)△H=+183kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol
4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-1164.4kJ/mol
则 N2(g)+3H2(g)?2NH3(g)△H=-92.2KJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
| N2 | H2 | NH3 | |
| 投料Ⅰ | 1.0mol/L | 3.0mol/L | 0 |
| 投料Ⅱ | 0.5mol/L | 1.5mol/L | 1.0mol/L |
②按投料Ⅱ进行反应,起始时反应进行的方向为正向(填“正向”或“逆向”).
③若升高温度,则合成氨反应的化学平衡常数变小(填“变大”、“变小”或“不变”).
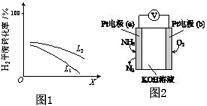
④L(L1、L2)、X可分别代表压强或温度.如图1表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系.
ⅰX代表的物理量是温度.
ⅱ判断L1、L2的大小关系,L1<L2.(填“>”“<”或“=”)
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意如图2:
①电极b上发生的是还原反应(填“氧化”或“还原”)
②写出电极a的电极反应式:2NH3-6e-+6OH-=N2+6H2O.

| A. | ③④ | B. | ②⑤ | C. | ①③④ | D. | ②③④⑤ |
| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
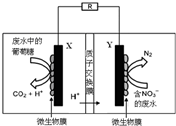
| A. | 电池工作时,既能净化废水,又能发电 | |
| B. | X电极为负极,工作时发生氧化反应 | |
| C. | 正极反应式为2NO3-+10e-+6H2O═N2↑+12OH- | |
| D. | 该电池在常温和高温时都可以工作 |
 .
.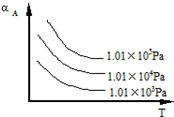 在一密闭容器中加入A、B进行可逆反应:A(g)+B(g)?m C(g)(m为整数),A的转化率(αA)与温度(T)、压强的关系如图所示:
在一密闭容器中加入A、B进行可逆反应:A(g)+B(g)?m C(g)(m为整数),A的转化率(αA)与温度(T)、压强的关系如图所示: