题目内容
18.下列各组物质的熔点均与所含化学键的键能有关的是( )| A. | CaO与CO2 | B. | NaCl与HCl | C. | SiC与SiO2 | D. | Cl2与I2 |
分析 物质的熔点均与所含化学键的键能有关,则对应的晶体一般为金属晶体、离子晶体或原子晶体,而分子晶体熔化时只克服分子间作用力,以此解答该题.
解答 解:A.CaO为离子化合物,熔化断裂离子键,而CO2在固体时是分子晶体,熔化时破坏的是分子间作用力,与化学键无关,故A错误;
B.NaCl为离子化合物,熔化断裂离子键,而HCl在固体时是分子晶体,熔化时破坏的是分子间作用力,与化学键无关,故B错误;
C.SiC与SiO2都是原子晶体,熔化断裂的是共价键,与化学键有关,故C正确;
D.Cl2与I2在固体时是分子晶体,熔化时破坏的是分子间作用力,与化学键无关,故D错误.
故选C.
点评 本题考查物质中的化学键,为高频考点,把握化学键的形成及化学键判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
8.下列关于苯的说法正确的是( )
| A. | 苯能使酸性高锰酸钾溶液褪色 | |
| B. | 苯分子具有平面正六边形结构,12个原子在同一平面上,对位上的4个原子在一条直线上 | |
| C. | 苯能使溴水褪色,是发生了取代反应 | |
| D. | 苯不含有碳碳双键故不能发生加成反应 |
9.常温下,有①Na2CO3溶液、②NaHCO3溶液、③氨水、④NH4Cl溶液各25mL,其物质的量浓度均为0.1mol•L-1.关于上述四种溶液的说法正确的是( )
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)=c(NH3•H2O) | |
| D. | 向③、④中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):③=④ |
13.下列离子方程式正确的是( )
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 苯酚与碳酸钠溶液反应:2C6H5OH+CO32-═2C6H5O-+CO2↑+H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]+$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O |
3.O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
| A. | 氧气是氧化产物 | |
| B. | O2F2既是氧化剂又是还原剂 | |
| C. | 若生成4.48 L HF,则转移0.8 mol电子 | |
| D. | 还原剂与氧化剂的物质的量之比为1:4 |
11.下列有关化学用语使用正确的是( )
| A. | CO2的球棍模型: | B. | 乙烷的结构式:CH3CH3 | ||
| C. | S2-的结构示意图: | D. | Na2S的电子式: |
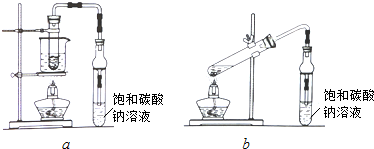
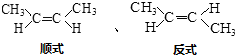 .
.