题目内容
10.乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备.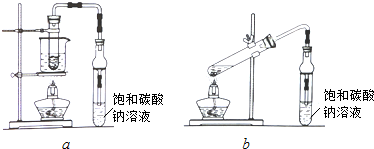
完成下列填空:
(1)实验时,通常加入过量的乙醇,原因是增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率.加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率;浓硫酸用量又不能过多,原因是浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率.
(2)饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解.
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,然后分液.
(4)若用b装置制备乙酸乙酯,其缺点有原料损失较大、易发生副反应.由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚,分离乙酸乙酯与该杂质的方法是蒸馏.
分析 (1)制备乙酸乙酯的反应为可逆反应,加入过量的乙醇可提高酯的产率,浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率,由于浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率;
(2)乙醇和乙酸可溶于水,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小;
(3)乙酸乙酯不溶于水,可分液分离;
(4)b由于不是水浴加热,温度不易控制,饮醋制备乙酸乙酯的缺点有原料损失较大、易发生副反应,由于乙醇溶液发生分子间脱水生成乙醚,乙醚和乙酸乙酯的沸点相差大,可蒸馏分离.
解答 解:(1)由于是可逆反应,因此加入过量的乙醇增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率.由于浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率,因此实际用量多于此量;由于浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率,所以浓硫酸用量又不能过多,
故答案为;增大反应物浓度,使平衡向生成酯的方向移动,提高酯的产率;浓H2SO4能吸收生成的水,使平衡向生成酯的方向移动,提高酯的产率;浓H2SO4具有强氧化性和脱水性,会使有机物碳化,降低酯的产率;
(2)由于生成的乙酸乙酯中含有乙醇和乙酸,所以饱和Na2CO3溶液的作用是中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解,
故答案为:中和乙酸、溶解乙醇、减少乙酸乙酯在水中的溶解;
(3)乙酸乙酯不溶于水,因此反应后,将试管中收集到的铲平倒入分液漏斗中,振荡、静置,然后分液即可,故答案为:振荡;静置;
(4)根据b装置可知由于不是水浴加热,温度不易控制,因此制备乙酸乙酯的缺点有原料损失较大、易发生副反应,由于乙醇溶液发生分子间脱水生成乙醚,所以b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是乙醚,乙醚和乙酸乙酯的沸点相差大,则分离乙酸乙酯与该杂质的方法是蒸馏,
故答案为:原料损失较大;易发生副反应;乙醚;蒸馏.
点评 本题考查乙酸乙酯的制备,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的严密性以及操作方法,把握实验原理,难度不大.

 口算能手系列答案
口算能手系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | 若两种元素形成XY2型化合物,其中XY2若形成分子晶体,则XY2是非极性分子 | |
| B. | 若两种元素形成YX2型化合物,则YX2既可能形成原子晶体,也可能形成分子晶体 | |
| C. | 若两种元素可形成YX型化合物,则YX的晶体一定属于离子晶体 | |
| D. | 若两种元素可形成YX3型化合物,则YX3的水溶液可能呈强碱性 |
| A. | CaO与CO2 | B. | NaCl与HCl | C. | SiC与SiO2 | D. | Cl2与I2 |
| 选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 浓盐酸、浓硫酸 | pH试纸 | 变红 | HCl为酸性气体 |
| C | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
| D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 6.02×1023b2/n | B. | b2/n | C. | n/b2 | D. | 6.02×1023b |
| A. | 5:2:3 | B. | 5:2:2 | C. | 9:3:1 | D. | 9:3:2 |
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Si.
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | 全部 |
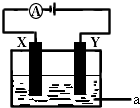 (1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C.