题目内容
6.将50mL2.0mol/LFe2(SO4)3溶液和150mL2.0mol/LH2SO4混合;在混和后的溶液中加入一定量Fe粉,充分反应后放出H2在标准状况下的体积为1.68L.(混合前后体积变化忽略不计)计算:(1)原混合液中Fe3+的物质的量浓度1mol/L
(2)最终溶液中H+物质的量浓度为2.25mol/L.
分析 (1)2.0 mol/L Fe2(SO4)3溶液中Fe3+的物质的量浓度为4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,据此计算;
(2)标准状况下1.68LH2的物质的量为0.075mol,根据H原子守恒可知溶液中H+浓度减小为$\frac{0.075mol×2}{0.2L}$=0.75mol/L,最终溶液中H+物质的量浓度为$\frac{4×150×1{0}^{-3}mol}{0.2L}$mol/L-0.75mol/L=2.25mol/L,由此解答.
解答 解:(1)2.0 mol/L Fe2(SO4)3溶液中Fe3+的物质的量浓度为4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,混合后溶液中Fe3+的物质的量浓度c(Fe3+)=$\frac{4mol/L×50mL×1{0}^{-3}L/mL}{(150+50)×1{0}^{-3}L}$=1mol/L.
故答案为:1mol/L;
(2)标准状况下1.68LH2的物质的量为0.075mol,根据H原子守恒可知溶液中H+浓度减小为$\frac{0.075mol×2}{0.2L}$=0.75mol/L,最终溶液中H+物质的量浓度为$\frac{4×150×1{0}^{-3}mol}{0.2L}$mol/L-0.75mol/L=2.25mol/L,故答案为:2.25mol/L.
点评 本题考查物质的量浓度的计算,稀释定律和元素守恒等方法在解题中的应用,难度中等,注意守恒思想的运用.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
1.短周期元素中的元素X原子的2p轨道和元素Y的3p轨道均有2个成单电子,则下列分析中正确的是( )
| A. | 若两种元素形成XY2型化合物,其中XY2若形成分子晶体,则XY2是非极性分子 | |
| B. | 若两种元素形成YX2型化合物,则YX2既可能形成原子晶体,也可能形成分子晶体 | |
| C. | 若两种元素可形成YX型化合物,则YX的晶体一定属于离子晶体 | |
| D. | 若两种元素可形成YX3型化合物,则YX3的水溶液可能呈强碱性 |
11.石油被称为“工业的血液”,以石油为原料不仅可以得到各种燃料油,还可以获得多种有机化工原料.请回答下列问题:
(1)将石蜡油与碎瓷片混合共热,产生的混合气体冷却至室温后,其成分如下:
将2mol该混合气体通入足量的溴的四氯化碳溶液中,消耗Br2的物质的量为1mol.
(2)经发现,石蜡油与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃M生成.0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.
①烃M的分子式为C6H12.
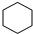
②烃N是烃M的一种同分异构体,其结构中含有4个甲基,则烃N的结构简式为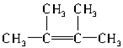 .
.
③烃N中一定处于同一平面的碳原子数为6.
④写出烃N发生自身加聚反应的化学方程式 .
.
(1)将石蜡油与碎瓷片混合共热,产生的混合气体冷却至室温后,其成分如下:
| 物质 | CH4 | CH3-CH3 | CH2═CH2 |
| 物质的量分数 | 20% | 30% | 50% |
(2)经发现,石蜡油与碎瓷片混合共热的产物中,除气态烃CH4、C2H6、CH2═CH2外,还有另一种液态烃M生成.0.2mol该液态烃在O2中完全燃烧时,得到的两种生成物的物质的量均为1.2mol.
①烃M的分子式为C6H12.
②烃N是烃M的一种同分异构体,其结构中含有4个甲基,则烃N的结构简式为
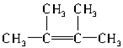 .
.③烃N中一定处于同一平面的碳原子数为6.
④写出烃N发生自身加聚反应的化学方程式
 .
.
18.下列各组物质的熔点均与所含化学键的键能有关的是( )
| A. | CaO与CO2 | B. | NaCl与HCl | C. | SiC与SiO2 | D. | Cl2与I2 |
15.已知n个某原子的质量为bg,则b个该原子的相对原子质量之和是( )
| A. | 6.02×1023b2/n | B. | b2/n | C. | n/b2 | D. | 6.02×1023b |
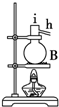
19.将下图所列仪器组装成一套实验室蒸馏石油的装置,并进行蒸馏得到汽油和煤油.
(1)上图中A、B、两种仪器的名称分别是冷凝管;蒸馏烧瓶;
(2)A仪器中,c口是进水口,
(3)蒸馏时,温度计水银球应在蒸馏烧瓶支管口位置.
(4)在B中注入原油后,再加几片碎瓷片的目的是防止暴沸.
| 三 | 一 | 五 | 二 | 六 | 四 |
 |  |  |  |  |  |
(2)A仪器中,c口是进水口,
(3)蒸馏时,温度计水银球应在蒸馏烧瓶支管口位置.
(4)在B中注入原油后,再加几片碎瓷片的目的是防止暴沸.
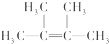 ;
;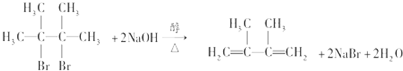 ;
; .
.