题目内容
9.常温下,有①Na2CO3溶液、②NaHCO3溶液、③氨水、④NH4Cl溶液各25mL,其物质的量浓度均为0.1mol•L-1.关于上述四种溶液的说法正确的是( )| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)=c(NH3•H2O) | |
| D. | 向③、④中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):③=④ |
分析 A.两溶液都促进了水的电离,水解程度越大,水的电离程度越大;
B.溶液中一定满足电荷守恒,根据电荷守恒判断;
C.③氨水、④NH4Cl混合后溶液呈碱性,说明一水合氨的电离程度大于铵根离子的水解程度;
D.加入等体积、等浓度的盐酸后,③为氯化铵溶液,④为氯化铵和氯化氢的混合液,④中氯化氢抑制了铵根离子的水解.
解答 解:A.Na2CO3的水解程度大于NaHCO3,则水的电离程度:①>②,故A错误;
B.①Na2CO3溶液、②NaHCO3溶液中都满足电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故B正确;
C.③、④混合,所得溶液的pH>7,说明一水合氨的电离程度大于铵根离子的水解程度,则该溶液中:c(NH4+)>c(NH3•H2O),故C错误;
D.向③、④中分别加入25mL0.1mol•L-1盐酸后,③为NH4Cl溶液,④为NH4和HCl的混合液,④中HCl电离出的氢离子抑制了NH4+的水解,在溶液中c(NH4+):③<④,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确电荷守恒、盐的水解原理为解答关键,注意掌握电离平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
19.一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)?2Z(g) 一定达到化学平衡状态的是( )
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③混合气体的平均摩尔质量不再发生变化
④单位时间内生成n mol Z,同时生成2n molY.
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③混合气体的平均摩尔质量不再发生变化
④单位时间内生成n mol Z,同时生成2n molY.
| A. | ①② | B. | ③④ | C. | ②③ | D. | ①④ |
20.判断物质在不同溶剂中的溶解性时,有一条经验规律:“极性分子组成的溶剂易溶解极性分子组成的溶质;非极性分子组成的溶剂易溶解非极性分子组成的溶质.”下列如图装置中,不宜用作HCl尾气吸收的是( )
| A. |  | B. |  | C. |  | D. | 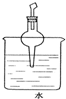 |
1.短周期元素中的元素X原子的2p轨道和元素Y的3p轨道均有2个成单电子,则下列分析中正确的是( )
| A. | 若两种元素形成XY2型化合物,其中XY2若形成分子晶体,则XY2是非极性分子 | |
| B. | 若两种元素形成YX2型化合物,则YX2既可能形成原子晶体,也可能形成分子晶体 | |
| C. | 若两种元素可形成YX型化合物,则YX的晶体一定属于离子晶体 | |
| D. | 若两种元素可形成YX3型化合物,则YX3的水溶液可能呈强碱性 |
18.下列各组物质的熔点均与所含化学键的键能有关的是( )
| A. | CaO与CO2 | B. | NaCl与HCl | C. | SiC与SiO2 | D. | Cl2与I2 |
2.氯只有35Cl和37Cl两种稳定同位素,它们在氯气中的原子个数之比35Cl:37Cl为3:1,则相对分子质量为70、72、74的氯气分子数之比可能是( )
| A. | 5:2:3 | B. | 5:2:2 | C. | 9:3:1 | D. | 9:3:2 |