题目内容
11.下列有关化学用语使用正确的是( )| A. | CO2的球棍模型: | B. | 乙烷的结构式:CH3CH3 | ||
| C. | S2-的结构示意图: | D. | Na2S的电子式: |
分析 A.CO2分子中碳原子最外层有4个电子,形成4个共价键;氧原子最外层有6个电子,形成2个共价键,为直线型结构,原子半径的大小碳原子大于氧原子,图中原子半径错误;
B.乙烷为含有2个碳原子的烷烃,结构式中应该将所有共价键用短线表示,选项中表示乙烷的结构简式;
C.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,用小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数,图中核外电子表示错误;
D.硫化钠是离子化合物,硫化钠的电子式中含有两个钠离子一个氯离子.
解答 解:A.二氧化碳存在2个C=O,是直线型结构:球棍模型: ,故A错误;
,故A错误;
B.乙烷分子中含有两个甲基,CH3CH3为乙烷的结构简式,乙烷的结构式为 ,故B错误;
,故B错误;
C.S2-的质子数为16,核外电子数为18,各层电子数分别为2、8、8,硫离子结构示意图为 ,故C错误;
,故C错误;
D.Na2S为离子化合物,钠离子用离子符号表示,硫离子标出最外层电子,硫化钠的电子式为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了化学用语的判断,属于基础知识的考查,题目难度不大,试题考查了学生规范答题的能力.

练习册系列答案
相关题目
18.下列各组物质的熔点均与所含化学键的键能有关的是( )
| A. | CaO与CO2 | B. | NaCl与HCl | C. | SiC与SiO2 | D. | Cl2与I2 |
2.氯只有35Cl和37Cl两种稳定同位素,它们在氯气中的原子个数之比35Cl:37Cl为3:1,则相对分子质量为70、72、74的氯气分子数之比可能是( )
| A. | 5:2:3 | B. | 5:2:2 | C. | 9:3:1 | D. | 9:3:2 |
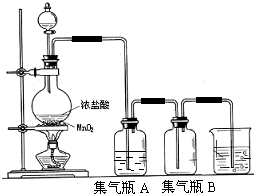
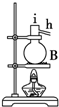
19.将下图所列仪器组装成一套实验室蒸馏石油的装置,并进行蒸馏得到汽油和煤油.
(1)上图中A、B、两种仪器的名称分别是冷凝管;蒸馏烧瓶;
(2)A仪器中,c口是进水口,
(3)蒸馏时,温度计水银球应在蒸馏烧瓶支管口位置.
(4)在B中注入原油后,再加几片碎瓷片的目的是防止暴沸.
| 三 | 一 | 五 | 二 | 六 | 四 |
 |  |  |  |  |  |
(2)A仪器中,c口是进水口,
(3)蒸馏时,温度计水银球应在蒸馏烧瓶支管口位置.
(4)在B中注入原油后,再加几片碎瓷片的目的是防止暴沸.
6.下列各组微粒中,电子总数相同的是( )
| A. | F-、Cl-、Br-、I- | B. | S2-、Ca2+、Ar、Cl- | ||
| C. | Na+、K+、Mg2+、Al3+ | D. | Mg2+、Mg、Al3+、Al |
3.下列物质中能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Si.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Si.
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | 全部 |
20.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | O.lmol过氧化钠中,阴阳离子总数为0.4 NA | |
| B. | 11.2L氯气通入足量的NaOH充分反应,转移的电子数目为0.5 NA | |
| C. | 17g NH3气体含σ键的数目为3NA | |
| D. | 1L O.lmol/L氨水中,OH-数目为0.1 NA |
1.常温下,用0.1mol•L-1NaOH溶液滴定0.1mol•L-1HA溶液,滴定曲线如下,下列分析错误的是( )
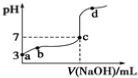

| A. | 由a点推知HA是弱酸 | B. | a、b点的溶液中,水的电离程度:a<b | ||
| C. | c点的溶液中:c(Na+)=c(A-)+c(HA) | D. | d点的溶液中:c(Na+)>c(A-) |