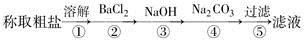
题目内容
8.常温下,将0.1L0.2mol/LKMnO4酸性溶液与一定量pH=3的草酸(HOOC-COOH)溶液混合,放出VL气体.NA代表阿伏加德罗常数的值,下列说法正确的是( )| A. | pH=3的草酸溶液含有H+数目为0.001NA | |
| B. | 当1molKMnO4被还原时强酸提供H+数目为NA | |
| C. | 1molHOOC-COOH含共用电子对数目为9NA | |
| D. | 该反应释放CO2分子数目为$\frac{V}{22.4}$NA |
分析 A、草酸溶液的体积不明确;
B、KMnO4酸性溶液与草酸溶液反应的离子方程式为:8MnO4-+5C2H2O4+54H+=8Mn2++10CO2↑+32H2O来计算;
C、HOOC-COOH中含1条C-C键,2条C-O键,2条O-H键和2条C=O键;
D、二氧化碳所处的状态不是标况.
解答 解:A、草酸溶液的体积不明确,故溶液中含有的氢离子的个数无法计算,故A错误;
B、KMnO4酸性溶液与草酸溶液反应的离子方程式为:2MnO4-+5C2H2O4+6H+=2Mn2++10CO2↑+8H2O,其中氢离子由高锰酸钾溶液中的强酸提供,而根据离子方程式可知,2mol高锰酸钾被还原时,有来自强酸的6mol氢离子反应,故当1mol高锰酸钾被还原时,强酸提供的氢离子为3mol即3NA个,故B错误;
C、HOOC-COOH中含1条C-C键,2条C-O键,2条O-H键和2条C=O键,故1mol草酸中含9mol共用电子对即9NA对,故C正确;
D、二氧化碳所处的状态不是标况,是常温下,气体摩尔体积不是22.4L/mol,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构

练习册系列答案
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
1.下列装置能达到相应实验目的是( )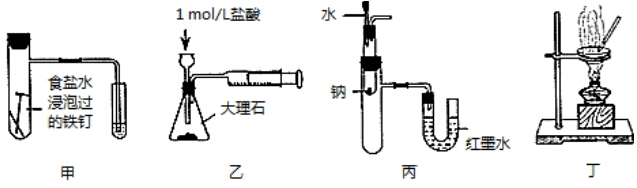

| A. | 用图甲装置验证铁发生析氢腐蚀 | |
| B. | 用图乙装置测定反应速率 | |
| C. | 用图丙装置验证Na和水反应的热效应 | |
| D. | 用图丁装置蒸干MgCl2溶液制备无水MgCl2 |
19.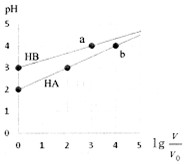 室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )
室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )
 室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )
室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )| A. | HA为强酸,HB为弱酸 | |
| B. | 水的电离程度a点大于b点 | |
| C. | 当pH=2时,HA溶液中$\frac{c(HA)}{c({A}^{-})}$=9 | |
| D. | 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)>c(Na+)>c(H+)>c(OH-) |
16.NA表示阿伏伽德罗常数的值,下列叙述不正确的是( )
| A. | 60g SiO2晶体含4NA个σ键 | |
| B. | 1mol[Cu(NH3)4]2+中含4NA配位键 | |
| C. | 在24g石墨中,含C-C共价键数目为6NA | |
| D. | CO和N2是等电子体,标况下22.4L的CO气体与1mol N2所含的电子数相等 |
3.根据下列结构示意图,判断下列说法中正确的是( )

| A. | 在NaCl晶体中,距Na+最近的多个Cl-构成正四面体 | |
| B. | 在CaF2晶体中,每个晶胞平均占有4个Ca2+ | |
| C. | 在金刚石晶体中,碳原子与碳碳键数之比为1:2 | |
| D. | 该气态团簇分子的分子式为EH或HE |