题目内容
16.下列递变情况不正确的是( )| A. | Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高,对应的气态氢化物的稳定性依次增强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | Na、K、Rb氧化物的水化物碱性依次增强 |
分析 A.Na、Mg、Al是同周期相邻的元素,最外层分别有1、2、3个电子,原子半径逐渐变小,原子还原性越弱,其对应简单阳离子氧化性越强;
B.P、S、Cl的最高正价分别为+5、+6、+7,依次增大,元素非金属性越强,其对应的气态氢化物的稳定性越强;
C.同周期元素原子半径随原子序数的增大应而逐渐减小;
D.元素的金属性越强,其氧化物对应的水化物的碱性越强.
解答 解:A.Na、Mg、Al是同周期相邻的元素,最外层分别有1、2、3个电子,依次增多,还原性强弱关系:Na>Mg>Al,元素原子还原性越弱,其对应简单阳离子氧化性越强,故A正确;
B.P、S、Cl的最高正价分别为+5、+6、+7,依次升高,非金属性P<S<Cl,元素非金属性越强,其对应的气态氢化物的稳定性越强,故B正确;
C.C、N、O是同周期从左到右排列的元素,从左到右,原子半径逐渐减小,故C错误;
D.金属性Na<K<Rb,元素的金属性越强,其氧化物对应的水化物的碱性越强,故D正确.
故选C.
点评 主要考查非金属元素、金属元素在元素周期表中的位置关系及其性质变化规律,难度不大,注意记忆理解元素周期律.

练习册系列答案
相关题目
7.合成氨是工业上的重要反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g),下列说法不正确的是( )
| A. | 反应达到平衡状态后,各物质浓度不变,反应停止 | |
| B. | 反应达到平衡状态后,单位时间内生成1molN2的同时消耗3molH2 | |
| C. | 在上述条件下,N2不可能100%转化为NH3 | |
| D. | 使用催化剂是为了加快反应速率,提高生产效率 |
4.下列有关说法正确的是( )
| A. | 1mol过氧化钠和足量水充分反应,理论上转移的电子数约为2×6.02×1023 | |
| B. | 电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 0.1mol•L-1醋酸溶液pH=a,0.01mol•L-1醋酸溶液pH=b,则a+1<b |
1.NiCl2是化工合成中最重要的镍源,工业上以金属镍废料为原料生产NiCl2,继而生产Ni2O3的工艺流程如图:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③增大盐酸的浓度(或将镍废料研成粉末等)等.
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3-、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05-0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示.

①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3-、Al3+等.沉镍前需加Na2CO3控制溶液pH范围为4.7~7.1.
(3)从滤液A中可回收利用的主要物质是NaCl.
(4)“氧化”生成Ni2O3的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O.
(5)工业上用镍为阳极,电解0.05-0.1mol•L-1NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉.当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示.

①NH4Cl的浓度最好控制为10 g•L-1.
②当NH4Cl浓度大于15g•L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:2H++2e-=H2↑(或2NH4++2H2O+2e-=H2↑+2NH3•H2O).
8.设NA代表阿佛加德罗常数的值,下列说法正确的是( )
| A. | 1molNH4Cl固体中共价键总数为5NA | |
| B. | 16gO2与O3的混合物中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入3molH2和1molN2,充分反应后得2NA个氨分子 | |
| D. | 18g水(H2O)含有8NA个电子 |
5.某有机物A用质谱仪测定示意图如图①,核磁共振氢谱示意图如图②,则A的结构简式可能为( )
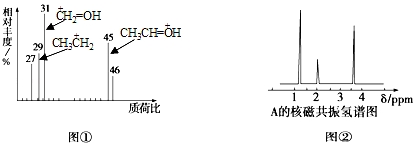

| A. | HCOOH | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2COOH |
4. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
(1)关于催化剂在实验过程中的催化作用,下列叙述正确的是AB(填序号)
A.降低了反应的活化能B.增大了反应的速率
C.降低了反应的焓变D.增大了反应的平衡常数
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
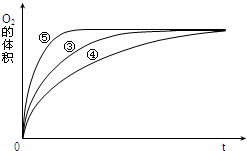
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
A.降低了反应的活化能B.增大了反应的速率
C.降低了反应的焓变D.增大了反应的平衡常数
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
