题目内容
17.下列说法中正确的是( )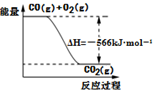
| A. | 6.8 g固体KHSO4与3.9 g固体Na2O2中阴离子数目相同 | |
| B. | 常温下铁、铜均不溶于浓硫酸,说明常温下铁、铜与浓硫酸均不反应 | |
| C. | 离子化合物中只含离子键 | |
| D. | 已知:2CO(g)+O2(g)═2CO2(g);△H=-566 kJ•mol-1,如图可表示由CO生成CO2的反应过程和能量关系 |
分析 A、6.8g固体KHSO4的物质的量为0.05mol、3.9g固体Na2O2的物质的量为0.05molo,每个化学式中阴离子个数都是1;
B、常温下铁遇到浓硫酸发生钝化反应,属于化学变化;
C、离子化合物中可能含有共价键,如氢氧化钠;
D、该反应为放热反应,但图象为1molCO,答案为2molCO.
解答 解:A、6.8g固体KHSO4的物质的量为0.05mol、3.9g固体Na2O2的物质的量为0.05molo,每个化学式中阴离子个数都是1,所以二者所含阴离子个数相等,故A正确;
B、常温下铁遇到浓硫酸发生钝化反应,属于化学变化,故B错误;
C、离子化合物中可能含有共价键,如氢氧化钠中含有共价键,故C错误;
D、该反应为放热反应,但图象为1molCO,答案为2molCO,故D错误.
故选A.
点评 本题考查了化学计量、化学键、热化学方程式等基础知识,难度不大,但容易错误,要求审题仔细.

练习册系列答案
相关题目
7.合成氨是工业上的重要反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$2NH3(g),下列说法不正确的是( )
| A. | 反应达到平衡状态后,各物质浓度不变,反应停止 | |
| B. | 反应达到平衡状态后,单位时间内生成1molN2的同时消耗3molH2 | |
| C. | 在上述条件下,N2不可能100%转化为NH3 | |
| D. | 使用催化剂是为了加快反应速率,提高生产效率 |
8.设NA代表阿佛加德罗常数的值,下列说法正确的是( )
| A. | 1molNH4Cl固体中共价键总数为5NA | |
| B. | 16gO2与O3的混合物中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入3molH2和1molN2,充分反应后得2NA个氨分子 | |
| D. | 18g水(H2O)含有8NA个电子 |
5.某有机物A用质谱仪测定示意图如图①,核磁共振氢谱示意图如图②,则A的结构简式可能为( )
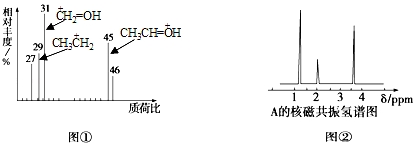

| A. | HCOOH | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2COOH |
12.下列有关资源综合利用的说法不正确的是( )
| A. | 煤的气化、液化均为化学变化,而石油的常压蒸馏和减压蒸馏均是物理变化 | |
| B. | 绿色化学的核心就是利用化学原理吸收处理工业生产污染物并将其转化为有用物质 | |
| C. | 利用石油的裂化可以提高汽油的产量和质量 | |
| D. | 将苦卤水浓缩、氧化,鼓入空气和水蒸气可提取溴 |
2.估计钙元素的电负性的取值范围( )
| A. | 小于0.8 | B. | 大于1.2 | C. | 在0.8与1.2之间 | D. | 在0.8与1.5之间 |
9.某有机物蒸气、空气燃烧时需3倍于其体积的氧气,产生2倍于其体积的CO2,该有机物是( )
| A. | CH4 | B. | C2H6 | C. | C2H5OH | D. | CH3CHO |
4. 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
(1)关于催化剂在实验过程中的催化作用,下列叙述正确的是AB(填序号)
A.降低了反应的活化能B.增大了反应的速率
C.降低了反应的焓变D.增大了反应的平衡常数
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
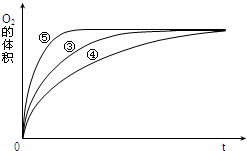
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
A.降低了反应的活化能B.增大了反应的速率
C.降低了反应的焓变D.增大了反应的平衡常数
(2)实验①和②的目的是探究浓度对反应速率的影响.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
5.某矿石主要含CuO和Cu2(OH)2CO3,以及少量Fe2O3、FeO和SiO2.按如下流程可制得Cu3N和铁红.下列说法不正确的是( )
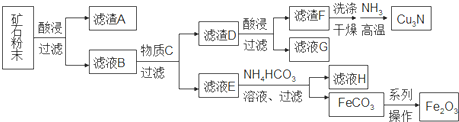

| A. | 在生成Cu3N的反应中,氨气做氧化剂 | |
| B. | 加入NH4HCO3溶液在生成白色沉淀的同时会放出有刺激气味的气体 | |
| C. | 虑液G可以并入滤液E加以利用 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |