题目内容
已知:C(s)+O2(g)=CO2(g)△H1O2(g)+2C(s)=2CO(g)△H22H2(g)+O2(g)=2H2O(g)△H3
CO(g)+H2O(g)=CO2(g)+H2(g)△H4下列关于上述反应焓变的判断正确的是( )
CO(g)+H2O(g)=CO2(g)+H2(g)△H4下列关于上述反应焓变的判断正确的是( )
| A、△H2>0 | ||||
B、一氧化碳的燃烧热△H=△H1-
| ||||
C、氢气的燃烧热△H=
| ||||
D、△H4=△H1-
|
考点:用盖斯定律进行有关反应热的计算
专题:
分析:A、碳不完全燃烧也是放热反应,因此△H2<0;
B、①C(s)+O2(g)=CO2(g)△H1②O2(g)+2C(s)=2CO(g)△H2,根据盖斯定律①-
②得:CO(g)+
O2(g)=CO2(g)△H=△H1-
△H2 ;
C、氢气的燃烧热生成的水应为液态水;
D、①C(s)+O2(g)=CO2(g)△H1
②O2(g)+2C(s)=2CO(g)△H2
③2H2(g)+O2(g)=2H2O(g)△H3
根据盖斯定律①-
②-
③得:CO(g)+H2O(g)=CO2(g)+H2(g)△H4=△H1-
△H2-
△H3.
B、①C(s)+O2(g)=CO2(g)△H1②O2(g)+2C(s)=2CO(g)△H2,根据盖斯定律①-
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
C、氢气的燃烧热生成的水应为液态水;
D、①C(s)+O2(g)=CO2(g)△H1
②O2(g)+2C(s)=2CO(g)△H2
③2H2(g)+O2(g)=2H2O(g)△H3
根据盖斯定律①-
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
解答:
解:A、碳不完全燃烧也是放热反应,因此△H2<0,故A错误;
B、①C(s)+O2(g)=CO2(g)△H1②O2(g)+2C(s)=2CO(g)△H2,根据盖斯定律①-
②得:CO(g)+
O2(g)=CO2(g)△H=△H1-
△H2 ,故B正确;
C、氢气的燃烧热生成的水应为液态水,而在2H2(g)+O2(g)=2H2O(g)△H3中,水是气态水,故C错误;
D、①C(s)+O2(g)=CO2(g)△H1
②O2(g)+2C(s)=2CO(g)△H2
③2H2(g)+O2(g)=2H2O(g)△H3
根据盖斯定律①-
②-
③得:CO(g)+H2O(g)=CO2(g)+H2(g)△H4=△H1-
△H2-
△H3,故D正确;
故选BD.
B、①C(s)+O2(g)=CO2(g)△H1②O2(g)+2C(s)=2CO(g)△H2,根据盖斯定律①-
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
C、氢气的燃烧热生成的水应为液态水,而在2H2(g)+O2(g)=2H2O(g)△H3中,水是气态水,故C错误;
D、①C(s)+O2(g)=CO2(g)△H1
②O2(g)+2C(s)=2CO(g)△H2
③2H2(g)+O2(g)=2H2O(g)△H3
根据盖斯定律①-
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故选BD.
点评:本题考查了盖斯定律的应用,难度不大,注意用“加合法”计算热化学方程式的焓变,明确燃烧热的定义.

练习册系列答案
相关题目
下列说法合理的是( )
| A、在稀硫酸中加入铜粉,铜粉不溶解;再加入K NO3 固体,铜粉仍不溶解 |
| B、将等物质的量Cl2与SO2通入品红溶液,漂白性增强 |
| C、浓H2SO4与Cu或C反应都需加热,浓硝酸与Cu或C反应都不需加热 |
| D、铝、氧化铝、小苏打、醋酸铵都既能与盐酸又能与氢氧化钠溶液反应 |
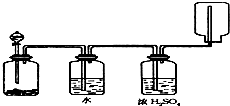 如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )
如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )| A、二氧化锰和双氧水反应生成氧气 |
| B、浓氨水和生石灰混合生成氨气 |
| C、Na2SO3和浓H2SO4混合生成SO2 |
| D、锌粒与稀盐酸混合生成H2 |
下列说法中正确的是( )
| A、常温下,某难溶物的Ksp为2.5×105 | ||||
| B、反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | ||||
C、NH3?H2O溶液加水稀释后,溶液中
| ||||
| D、常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
在甲、乙两个密闭容器中,发生如下反应:2A(g)?B(g)+2C(s);△H=mkJ?mol-1.有如图两种图象.下列叙述正确的是( )


| A、若甲为恒容体系,图象(Ⅰ)代表温度不同时,时间与B的体积分数关系图,则m>0 |
| B、恒温条件下,图象 (Ⅰ)可能代表压强不同时,时间与B的体积分数关系图 |
| C、恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充入2molA,乙中充入1molB、3molC,则达到平衡后两容器中B的体积分数一定不同 |
| D、恒温条件下,乙容器存在图象 (Ⅱ)的关系,则当x代表压强时,y可代表B的体积分数 |
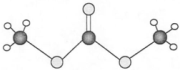
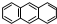 分子式C14H10)反应生成蒽醌(
分子式C14H10)反应生成蒽醌(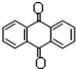 分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.
分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.