题目内容
下列说法合理的是( )
| A、在稀硫酸中加入铜粉,铜粉不溶解;再加入K NO3 固体,铜粉仍不溶解 |
| B、将等物质的量Cl2与SO2通入品红溶液,漂白性增强 |
| C、浓H2SO4与Cu或C反应都需加热,浓硝酸与Cu或C反应都不需加热 |
| D、铝、氧化铝、小苏打、醋酸铵都既能与盐酸又能与氢氧化钠溶液反应 |
考点:铜金属及其重要化合物的主要性质,常见金属元素的单质及其化合物的综合应用
专题:几种重要的金属及其化合物
分析:A、根据铜的化学性质,如:铜不能与非氧化性酸反应,但可以和氧化性酸反应,据此分析;
B、氯气与二氧化硫发生氧化还原反应,据此分析即可;
C、浓硝酸与C反应需要加热,据此分析即可;
D、依据铝及其氧化物具有两性、碳酸氢钠的两性以及醋酸跟和铵根的性质回答即可.
B、氯气与二氧化硫发生氧化还原反应,据此分析即可;
C、浓硝酸与C反应需要加热,据此分析即可;
D、依据铝及其氧化物具有两性、碳酸氢钠的两性以及醋酸跟和铵根的性质回答即可.
解答:
解:A、铜与稀HNO3反应,由该反应的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,故A错误;
B、氯气与二氧化硫反应生成盐酸和硫酸:Cl2+SO2+2H2O=H2SO4+2HCl,故B错误;
C、C与浓硝酸反应需要加热,故C错误;
D、铝、氧化铝、小苏打、醋酸铵都既能与盐酸又能与氢氧化钠溶液反应,故D正确;
故选D.
B、氯气与二氧化硫反应生成盐酸和硫酸:Cl2+SO2+2H2O=H2SO4+2HCl,故B错误;
C、C与浓硝酸反应需要加热,故C错误;
D、铝、氧化铝、小苏打、醋酸铵都既能与盐酸又能与氢氧化钠溶液反应,故D正确;
故选D.
点评:本题主要考查了金属铜的化学性质,氯气的性质、二氧化硫的性质以及两性化合物等知识.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中CO2+SO2+3OH-=HSO3-+CO32-+H2O |
| B、向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓ |
| C、向Fe(NO3)3溶液中加入过量的HI溶液 2NO3-+8H++6I-=3I2+2NO↑+4H2O |
| D、将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO3-+Ba2++OH-=BaCO3↓+H2O |
下列实验现象预测正确的是( )
A、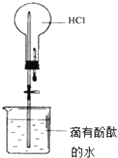 打开止水夹,烧瓶内出现红色喷泉 |
B、 酸性KMnO4溶液中出现气泡,颜色无明显变化 |
C、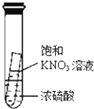 静置一段时间,小试管内有晶体析出 |
D、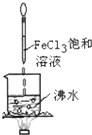 烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊 |
已知:C(s)+O2(g)=CO2(g)△H1O2(g)+2C(s)=2CO(g)△H22H2(g)+O2(g)=2H2O(g)△H3
CO(g)+H2O(g)=CO2(g)+H2(g)△H4下列关于上述反应焓变的判断正确的是( )
CO(g)+H2O(g)=CO2(g)+H2(g)△H4下列关于上述反应焓变的判断正确的是( )
| A、△H2>0 | ||||
B、一氧化碳的燃烧热△H=△H1-
| ||||
C、氢气的燃烧热△H=
| ||||
D、△H4=△H1-
|
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A、X与Y形成的化合物中,X可以显负价,Y显正价 |
| B、最高正化合价:X大于Y |
| C、第一电离能可能Y小于X |
| D、气态氢化物的稳定性:HmY小于HnX |