题目内容
13.下列物质的电离方程式正确的是( )| A. | H2CO3═2H++CO32- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3?Na++HCO3- | D. | Ba(OH)2═Ba2++2OH- |
分析 A.多元弱酸分步电离;
B.NaHSO4是强酸强碱酸式盐,完全电离出Na+、H+、SO42-离子;
C.NaHCO3是弱酸强碱酸式盐,完全电离出Na+、HCO3-离子;
D.Ba(OH)2完全电离出钡离子和氢氧根离子.
解答 解:A.多元弱酸分步电离,H2CO3为二元弱酸,H2CO3的水溶液电离方程式:H2CO3?HCO3-+H+ 和HCO3-?CO32-+H+,故A错误;
B.NaHSO4是强酸强碱酸式盐,完全电离出Na+、H+、SO42-离子,其电离方程式为:NaHSO4=Na++H++SO42-,故B错误;
C.NaHCO3是弱酸强碱酸式盐,完全电离出Na+、HCO3-离子,电离方程式为:NaHCO3═Na++HCO3-,故C错误;
D.Ba(OH)2完全电离出钡离子和氢氧根离子,电离方程式为:Ba(OH)2═Ba2++2OH-,故D正确.
故选D.
点评 本题考查了电离方程式的书写,掌握电离方程式的书写方法并能灵活运用是正确解答此类题的关键,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
11.五种短周期元素的性质或原子结构信息如表:
请根据表中信息回答下列问题:
(1)Q原子的电子排布式为1s22s22p2,其同位素有12C、13C、14C.
(2)R与Z组成的化合物的化学式是Na2O、Na2O2.
(3)X气态氢化物分子的空间构型为三角锥形.X的最高价氧化物对应的水化物其浓溶液与同类物质相比在化学性质上表现的特殊性有不稳定性和强氧化性.
(4)Y单质与V2O5反应的化学方程式为10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(5)在1.01×105Pa、298K时,1.4gQR气体在1.6gR2气体中完全燃烧,生成QR2气体时放出14.15kJ热量,表示QR燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol.
| 元素 | 元素性质或原子结构信息 |
| Q | 原子核外有6种不同运动状态的电子 |
| R | 最外层电子数是次外层电子数的3倍 |
| X | 气态氢化物的水溶液呈弱碱性 |
| Y | 第三周期元素的简单离子中离子半径最小 |
| Z | 单质为银白色固体,在空气中燃烧发出黄色火焰 |
(1)Q原子的电子排布式为1s22s22p2,其同位素有12C、13C、14C.
(2)R与Z组成的化合物的化学式是Na2O、Na2O2.
(3)X气态氢化物分子的空间构型为三角锥形.X的最高价氧化物对应的水化物其浓溶液与同类物质相比在化学性质上表现的特殊性有不稳定性和强氧化性.
(4)Y单质与V2O5反应的化学方程式为10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(5)在1.01×105Pa、298K时,1.4gQR气体在1.6gR2气体中完全燃烧,生成QR2气体时放出14.15kJ热量,表示QR燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol.
8.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 操作 | 现象 | 解释或结论 |
| A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带正电 |
| B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3 氧化,形成致密的氧化膜 |
| C | 将过量的过氧化钠投入 滴有酚酞试液的水中 | 最终得红色溶液 | 过氧化钠与水反应生成碱性物质 |
| D | 将镁粉和铝粉的混合物加 入过量的烧碱溶液中 | 仍有未溶解粉末 | 铝粉能与烧碱溶液反应,而镁粉不反应 |
| A. | A | B. | B | C. | C | D. | D |
5.下列物质的贮存方法不正确的是( )
| A. | 液氯储存在钢瓶中 | B. | 液溴装入试剂瓶中应加少量水液封 | ||
| C. | 固体碘保存在CCl4中 | D. | 氢氟酸盛放在塑料瓶中 |
2.已知反应:3BrF3+5H2O=HBrO3+9HF+O2↑+Br2,如有3mol H2O参加反应,则被H2O还原的BrF3的物质的量为( )
| A. | 1.2mol | B. | 2mol | C. | 0.8mol | D. | 1.8mol |
3. 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数的表达式是K=$\frac{c(CH{\;}_{3}OH)}{c(CO)•c{\;}^{2}(H{\;}_{2})}$,由表中数据判断△H<0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为250℃,则反应速率v(H2)=0.4mol•L-1•min-1.
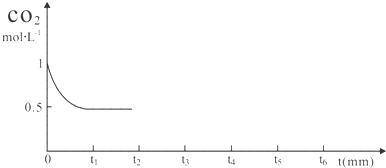
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的$\frac{1}{2}$,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol.请写出CH3OH(l)完全燃烧生成二氧化碳和液态水的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1.
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H.下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为250℃,则反应速率v(H2)=0.4mol•L-1•min-1.
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)?CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的$\frac{1}{2}$,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇).
(4)如果用CH3OH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.