题目内容
17.下列反应的离子方程式书写正确的是( )| A. | 向沸水中滴加饱和氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
分析 A.水解生成胶体,不是沉淀;
B.苏打为碳酸钠;
C.醋酸在离子反应中保留化学式;
D.反应生成氯化铁,电子、电荷守恒.
解答 解:A.向沸水中滴加饱和氯化铁溶液的离子反应为Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故A错误;
B.澄清石灰水与少量苏打溶液混合的离子反应为Ca2++CO32-═CaCO3↓,故B错误;
C.碳酸钙溶于醋酸的离子反应为CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O,故C错误;
D.氯化亚铁溶液中通入氯气的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
7.下列物质中含有NA个氯化氢分子的是( )
| A. | 将1mol H2和1mol Cl2 光照或点燃后的产物 | |
| B. | 室温下22.4L HCl气体 | |
| C. | 室温下,将1mol HCl气体通入100mL水中所得溶液 | |
| D. | 室温下,36.5g HCl气体 |
5.3.04g铜镁合金完全溶解于100mL14.0mol•L-1的浓硝酸中,得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入2.0mol•L-1NaOH溶液,当金属离子完全沉淀时,得到5.08g沉淀.下列说法不正确的是( )
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 被还原的硝酸的物质的量是0.12mol | |
| C. | 得到5.08g沉淀时,加入NaOH溶液的体积是700mL | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
5.分子式为C4H1Cl9的同分异构体共有(不考虑立体异构)( )
| A. | 4种 | B. | 7种 | C. | 9种 | D. | 10种 |
12.用下列装置进行相应实验,能达到实验目的是( )
| A. | 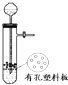 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 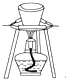 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 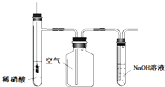 图所示装置用于制备并收集NO气体 图所示装置用于制备并收集NO气体 | |
| D. | 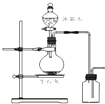 图所示装置制取并收集氨气 图所示装置制取并收集氨气 |
9.地壳中含量居于第二位的金属元素是( )
| A. | Al | B. | Si | C. | Fe | D. | O |
10.酸雨的pH小于5.6,下列气体排放会形成酸雨的是( )
| A. | N2 | B. | CO2 | C. | SO2 | D. | 氟氯代烷 |
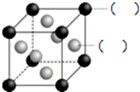 A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得.请回答下列问题:
A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得.请回答下列问题: ;
;