题目内容
10.酸雨的pH小于5.6,下列气体排放会形成酸雨的是( )| A. | N2 | B. | CO2 | C. | SO2 | D. | 氟氯代烷 |
分析 正常雨水的pH约为5.6,雨水中溶解SO2,雨水的酸性增强,则酸雨的pH小于5.6,以此来解答.
解答 解:A.N2为空气的主要成分,不是污染物,故A不选;
B.CO2不是空气污染物,可导致温室效应,故B不选;
C.雨水中溶解SO2,雨水的酸性增强,则酸雨的pH小于5.6,故C选;
D.氟氯代烷可破坏臭氧层,导致臭氧空洞,与酸雨无关,故D不选;
故选C.
点评 本题考查化学与环境污染,为高频考点,把握常见的环境问题及污染物的排放为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
17.下列反应的离子方程式书写正确的是( )
| A. | 向沸水中滴加饱和氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
18.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1molCH3+(甲基碳正离子)含有的电子数目为9NA | |
| B. | 27g Al在标准状况下的22.4L Cl2中燃烧,转移的电子总数为3 NA | |
| C. | 0.2 mol•L-1的Na2CO3溶液中含有CO32-的数目一定小于0.2NA | |
| D. | 7.8gNa2S和Na2O2的混合物中含有的阴离子总数为0.1 NA |
15.向溴化钠、碘化钠的混合溶液中通入足量氯气,加热将溶液蒸干,并灼烧至质量不再改变为止,最后残留的物质是( )
| A. | NaCl | B. | NaCl、NaBr、NaI | C. | NaBr、NaI | D. | NaI |
2.X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
(1)W位于元素周期表第三周期第ⅣA族;W的原子半径比X的大(填“大”或“小”).
(2)Z的第一电离能比W的小(填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是分子间作用力;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称乙醇、乙酸等
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是Si+4HF=SiF4↑+2H2↑
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是2Al(s)+3O2(g)=2Al2O3(s)△H=-3352kJ/mol.
| 元素 | 相关信息 |
| X | X的最高价氧化为对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(2)Z的第一电离能比W的小(填“大”或“小”);XY2由固态变为气态所需克服的微粒间作用力是分子间作用力;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称乙醇、乙酸等
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是先生成白色沉淀,后沉淀逐渐溶解,最后变成无色溶液;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是Si+4HF=SiF4↑+2H2↑
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是2Al(s)+3O2(g)=2Al2O3(s)△H=-3352kJ/mol.
20.锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH-+2H2O═2Zn(OH)${\;}_{4}^{2-}$.下列说法正确的是( )
| A. | 充电时,电解质溶液中K+向阳极移动 | |
| B. | 放电时,电解质溶液中K+向正极移动 | |
| C. | 充电时,阳极反应为:Zn(OH)${\;}_{4}^{2-}$+2e-═Zn+4OH- | |
| D. | 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况) |
 ”和画“×”分别标明B和N的相对位置.
”和画“×”分别标明B和N的相对位置.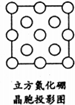

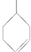 .
.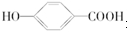 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) .
.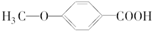 的同分异构体很多,其中符合下列条件的有3种.
的同分异构体很多,其中符合下列条件的有3种. .
.