题目内容
10.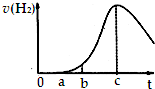 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )| A. | 曲线由0→a段发生了氧化还原反应 | |
| B. | 曲线由b→c段,产生氢气的速率增加较快的主要原因是反应放热 | |
| C. | c点达到了平衡 | |
| D. | c点以后,反应逐渐消耗了产生的氢气 |
分析 由图可知,开始不生成氢气,为氧化铝与硫酸的反应,然后Al与硫酸反应生成氢气,开始温度较低,由于反应放热,则温度升高反应速率加快,后来,氢离子浓度减小,则反应速率减小,以此来解答.
解答 解;A.曲线由0→a段不产生氢气是因表面的氧化物隔离了铝和硫酸溶液,氧化铝与硫酸反应生成硫酸铝和水,离子反应为Al2O3+6H+=2Al3++3H2O,不是氧化还原反应,故A错误;
B.曲线由b→c段,产生氢气的速率增加较快的主要原因为该反应为放热反应,温度升高,反应速率加快,故B正确;
C.反应不是可逆反应,随反应进行反应放热对速率的影响比浓度减少的影响大,当t=c时温度影响最大,t>c时温度影响不是主要因素,浓度减少是主要因素,故C错误;
D.曲线由c以后,产生氢气的速率逐渐下降的主要原因为氢离子浓度减小,反应速率减小,不会消耗产生的氢气,故D错误.
故选B.
点评 本题考查Al的化学性质及影响反应速率的因素,为高频考点,把握温度、浓度对反应速率的影响及氧化铝、Al与酸的反应为解答的关键,侧重分析能力的考查,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
1.实验室用锌粒与2mol•L-1硫酸溶液制取氢气,下列措施能增大氢气产生速率的是( )
| A. | 将稀硫酸改成浓硫酸 | B. | 滴加少量硫酸钠溶液 | ||
| C. | 硫酸改成4 mol•L-1的醋酸 | D. | 滴加几滴硫酸铜溶液 |
18.电浮选凝聚法处理酸性污水的工作原理如图.下列说法正确的是( )
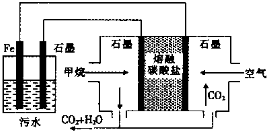

| A. | 左侧装置中的铁电极可换成石墨电极 | |
| B. | 通入甲烷的石墨电极的电极反应式为:CH4+4CO32--8e-═5CO2+2H2O | |
| C. | 通入空气的石墨电极做正极,发生氧化反应 | |
| D. | 若左侧装置中石墨电极产生标准状况下气体44.8L气体,则消耗2mol甲烷 |
5.下列说法正确的是( )
| A. | 决定某化学反应反应速率的主要因素是催化剂 | |
| B. | 青霉素、橡胶、阿斯匹林全部由化学合成制得 | |
| C. | 铝有还原性,在反应中放出大量热能用来冶炼难熔金属Mn等 | |
| D. | 陶瓷品、酒精、乙烯塑料等的使用不会对环境造成污染 |
15.a g Mg、Al合金完全溶解在c1 mol•L-1、V1L HCl溶液中,产生b mol H2.再向反应后的溶液中加入c2mol•L-1、V2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g.下列关系不正确的是( )
| A. | 铝的质量为$\frac{24b-a}{9}$g | |
| B. | c1=$\frac{{c}_{2}{V}_{2}}{{V}_{1}}$ | |
| C. | d=a+34b | |
| D. | 与金属反应后剩余盐酸为(c1V1-2b)mol |
2.现有三组溶液:①汽油和氯化钠溶液 ②49%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |