题目内容
2.现有三组溶液:①汽油和氯化钠溶液 ②49%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
分析 ①汽油和氯化钠溶液,混合分层;②49%的乙醇溶液中乙醇与水的沸点不同,③单质溴不易溶于水,易溶于有机溶剂,以此来解答.
解答 解:①汽油和氯化钠溶液,混合分层,则选择分液法分离;
②49%的乙醇溶液中乙醇与水的沸点不同,则选择蒸馏法分离;
③单质溴不易溶于水,易溶于有机溶剂,则选择萃取法分离,
故选A.
点评 本题考查混合物分离、提纯的方法及选择,为高频考点,把握物质的性质及性质差异、混合物分离方法为解答的关键,注重实验基础知识和基本技能的考查,注意有机物性质,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
12.如图为某化学兴趣小组设计的一个原电池,装置中电流表的指针发生偏转,则X应为( )


| A. | 水 | B. | 酒精 | C. | 稀硫酸 | D. | 植物油 |
13.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$\stackrel{丁}{→}$丙.下列4种推断正确的是( )
①若甲为氨气,则丁可能是O2
②若丁是氢氧化钠溶液,则甲可能是一种能使品红溶液褪色的气体
③若甲为碳,则丙在一定条件下可与甲反应
④若甲为硝酸银溶液,则乙可能是一种沉淀.
①若甲为氨气,则丁可能是O2
②若丁是氢氧化钠溶液,则甲可能是一种能使品红溶液褪色的气体
③若甲为碳,则丙在一定条件下可与甲反应
④若甲为硝酸银溶液,则乙可能是一种沉淀.
| A. | ①②④ | B. | ①②③④ | C. | ①②③ | D. | ①③④ |
10.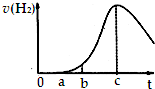 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )
 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )| A. | 曲线由0→a段发生了氧化还原反应 | |
| B. | 曲线由b→c段,产生氢气的速率增加较快的主要原因是反应放热 | |
| C. | c点达到了平衡 | |
| D. | c点以后,反应逐渐消耗了产生的氢气 |
17.我国海洋资源丰富,开发利用具有广阔前景.
(1)利用海水可制备氯气.
①制得的氯气,为便于储存,要将其液化[C12(g)?Cl2(l)],应采取的措施是降温(或加压)(只写出一种措施).
②液氯储存区贴有的说明卡如表(部分):
用离子方程式表示“泄漏处理”中NaHSO3溶液的作用.HSO3-+C12+H2O=SO42-+2C1-+3H+
若氯气泄漏后遇到苯,在钢瓶表面氯气和苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯气与苯的反应有催化作用
(2)利用海水脱硫可解决燃煤排放SO2造成的环境问题,工艺流程如图:
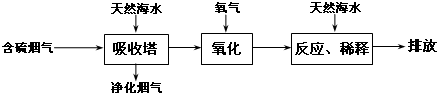
①天然海水呈碱性,写出SO2与过量海水中OH-的反应的离子方程式.SO2+2OH-=SO32-+H2O
②天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,请写出氧化过程中H2SO3被氧化的化学方程式:2H2SO3+O2=2H2SO4;氧化后的“海水”需要引入大量的天然海水与之混合才能排放,该操作的主要目的是中和经氧气氧化后海水中生成的酸【或中和酸;降低氧化后溶液的酸性】
(3)工业从海水中提溴的过程如下:
海水$\stackrel{除去悬浮杂质}{→}$$\stackrel{浓缩}{→}$$→_{氧化}^{氧化剂}$$\stackrel{热空气}{→}$Br2(g)$→_{吸收}^{Na_{2}CO_{3}溶液}$$[\begin{array}{l}{NaBr}\\{NaBr{O}_{3}}\end{array}]$$\stackrel{H_{2}SO_{4}}{→}$Br2
①通过热空气的目的是将Br2吹出
②溶液中的NaBr、NaBrO3用足量的硫酸处理后得到Br2单质,每生成1mol Br2转移电子的物质的量是1.67mol.
(1)利用海水可制备氯气.
①制得的氯气,为便于储存,要将其液化[C12(g)?Cl2(l)],应采取的措施是降温(或加压)(只写出一种措施).
②液氯储存区贴有的说明卡如表(部分):
| 危险性 | 危险品 |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质,设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
若氯气泄漏后遇到苯,在钢瓶表面氯气和苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯气与苯的反应有催化作用
(2)利用海水脱硫可解决燃煤排放SO2造成的环境问题,工艺流程如图:

①天然海水呈碱性,写出SO2与过量海水中OH-的反应的离子方程式.SO2+2OH-=SO32-+H2O
②天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,请写出氧化过程中H2SO3被氧化的化学方程式:2H2SO3+O2=2H2SO4;氧化后的“海水”需要引入大量的天然海水与之混合才能排放,该操作的主要目的是中和经氧气氧化后海水中生成的酸【或中和酸;降低氧化后溶液的酸性】
(3)工业从海水中提溴的过程如下:
海水$\stackrel{除去悬浮杂质}{→}$$\stackrel{浓缩}{→}$$→_{氧化}^{氧化剂}$$\stackrel{热空气}{→}$Br2(g)$→_{吸收}^{Na_{2}CO_{3}溶液}$$[\begin{array}{l}{NaBr}\\{NaBr{O}_{3}}\end{array}]$$\stackrel{H_{2}SO_{4}}{→}$Br2
①通过热空气的目的是将Br2吹出
②溶液中的NaBr、NaBrO3用足量的硫酸处理后得到Br2单质,每生成1mol Br2转移电子的物质的量是1.67mol.
7.区别NaCl、FeCl3和NH4Cl三种溶液,可选用下列试剂中的( )
| A. | KSCN溶液 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | 溶液BaCl2 |
14.如表各组物质中,Y是X物质中含有的少量杂质,Z是除杂试剂,其中所加试剂最合理的一组是( )
| X | Y | Z | |
| A | NaHCO3溶液 | Na2CO3 | Ba(OH)2溶液 |
| B | Fe2O3 | Al2O3 | NaOH溶液 |
| C | FeCl3溶液 | CuCl2 | Fe |
| D | Na2SO4溶液 | Na2CO3 | 盐酸 |
| A. | A | B. | B | C. | C | D. | D |
11.运用铝及其化合物有关知识,回答下列问题:
(1)如图1四个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量,从A~D中选择符合各题要求的序号填入表

(2)测定某镁铝合金中铝含量的实验装置图如图2(夹持仪器略).
实验步骤:
步骤1:连接装置并检查装置气密性;
步骤2:称取mg镁铝合金样品置于烧瓶中,在分液漏斗中盛放足量的溶液X;
步骤3:打开分液漏斗活塞b,使反应进行,待不再产生气泡时关闭活塞b;
步骤4:待装置冷却后,调平量筒与水槽的液面,读取气体体积为xmL(折合成标准状况下干燥气体的体积).
①测定氢气体积的装置选择A(填A或B)
②为了使合金中的铝与X反应,而Mg不反应,X应选用NaOH(填化学式),反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.③计算合金中铝的质量分数为$\frac{54x}{67.2m×1{0}^{3}}$(用m,x的代数式表示).
(1)如图1四个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量,从A~D中选择符合各题要求的序号填入表

| 溶液 | 加入的物质 | 答案序号 |
| AlCl3溶液 | 通入过量的NH3 | ① |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | ② |
| NaAlO2溶液 | 滴加稀H2SO4至过量 | ③ |
| MgCl2和AlCl3的混合液 | 滴加NaOH溶液至过量 | ④ |
实验步骤:
步骤1:连接装置并检查装置气密性;
步骤2:称取mg镁铝合金样品置于烧瓶中,在分液漏斗中盛放足量的溶液X;
步骤3:打开分液漏斗活塞b,使反应进行,待不再产生气泡时关闭活塞b;
步骤4:待装置冷却后,调平量筒与水槽的液面,读取气体体积为xmL(折合成标准状况下干燥气体的体积).
①测定氢气体积的装置选择A(填A或B)
②为了使合金中的铝与X反应,而Mg不反应,X应选用NaOH(填化学式),反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.③计算合金中铝的质量分数为$\frac{54x}{67.2m×1{0}^{3}}$(用m,x的代数式表示).
12.如表各组溶液电解一段时间后,再加入相关物质,溶液能恢复原来组成的是( )
| 电解质溶液 | 阳极 | 阴极 | 加入的物质 | |
| A | NaCl溶液 | 碳 | 铁 | 盐酸 |
| B | 稀硫酸 | 铜 | 碳 | 水 |
| C | 硫酸铜溶液 | 铜 | 碳 | 硫酸铜 |
| D | NaOH溶液 | 碳 | 铁 | 水 |
| A. | A | B. | B | C. | C | D. | D |