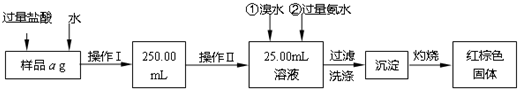
题目内容
15.a g Mg、Al合金完全溶解在c1 mol•L-1、V1L HCl溶液中,产生b mol H2.再向反应后的溶液中加入c2mol•L-1、V2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为d g.下列关系不正确的是( )| A. | 铝的质量为$\frac{24b-a}{9}$g | |
| B. | c1=$\frac{{c}_{2}{V}_{2}}{{V}_{1}}$ | |
| C. | d=a+34b | |
| D. | 与金属反应后剩余盐酸为(c1V1-2b)mol |
分析 首先发生反应:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,加入NaOH溶液恰好使沉淀达到最大值,若盐酸剩余,首先发生反应HCl+NaOH═NaCl+H2O(盐酸不剩余,则不发生该反应),然后发生反应AlCl3+3NaOH═Al(OH)3↓+3NaCl,MgCl2+2NaOH═MgAl(OH)2↓+2NaCl.
A.设合金中含有xmolMg,ymolAl,根据生成氢气的物质的量和金属的质量可列方程组计算合金中镁和铝的物质的量,进而计算Al的质量;
B.反应后溶液的成分为NaCl,根据原子守恒可知n(HCl)=n(NaCl)=n(NaOH);
C.根据电荷守恒可知,金属提供电子物质的量等于沉淀中氢氧根离子的物质的量,根据电子转移计算金属提供的电子,沉淀质量=m(金属)+m(沉淀中氢氧根);
D.总盐酸的物质的量减去生成氢气所用盐酸的物质的量即为剩余盐酸的物质的量.
解答 解:首先发生反应:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,加入NaOH溶液恰好使沉淀达到最大值,若盐酸剩余,首先发生反应HCl+NaOH═NaCl+H2O(盐酸不剩余,则不发生该反应),然后发生反应AlCl3+3NaOH═Al(OH)3↓+3NaCl,MgCl2+2NaOH═MgAl(OH)2↓+2NaCl.
A.设合金中含有xmolMg,ymolAl,反应的化学方程式分别为:Mg+2HCl═MgCl2+H2↑,2Al+6HCl═2AlCl3+3H2↑,产生b mol H2,则:$\left\{\begin{array}{l}{24x+27y=a}\\{x+1.5y=b}\end{array}\right.$,解得y=$\frac{24b-a}{9}$,则Al的质量为$\frac{24b-a}{9}$×27g/mol=(72b-3a)g,故A错误;
B.反应后溶液的成分为NaCl,根据原子守恒可知n(HCl)=n(NaCl)=n(NaOH),则C1×V1=C2×V2,故C1=$\frac{{c}_{2}{V}_{2}}{{V}_{1}}$,故B正确;
C.根据电子转移守恒可知,金属提供的电子物质的量为bmol×2=2bmol,根据电荷守恒可知,金属提供电子物质的量等于沉淀中氢氧根离子的物质的量,则d=a+2b×17=a+34b,故C正确;
D.生成bmolH2,根据氢元素守恒,可知消耗盐酸2bmol,则剩余HCl为(c1V1-2b)mol,故D正确;
故选A.
点评 本题考查混合物的计算,难度较大,关键是理解反应过程,利用守恒的方法计算,侧重对解题方法技巧与思维能力的考查.

 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.Ⅰ、已知反应N2O4(g)?2NO2(g)△H,随温度升高,混合气体的颜色变深.将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况.下列说法能说明透光率不再发生改变的有ad.
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
Ⅱ、用NH3催化还原NOx可以消除氮氧化物的污染.右下图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:
NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g).
(1)该反应的△S>0(填“>”、“=”或“<”).
(2)以下说法正确的是C.
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
Ⅲ、用CH4催化还原NOx也可以消除氮氧化物的污染.
(3)已知:CH4(g)的标准燃烧热为-890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1114kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=-114kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-844kJ/mol.
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
②T1<T2(填“>”或“<”,下空同);判断理由是升高温度,NO2的物质的量增大,平衡逆向移动,正反应为放热反应.
③T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4.
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减小(填“增大”、“减小”或“不变”).

| A. | 用装置①量取15.00mL的NaOH溶液 | |
| B. | 用装置②制备并收集Cl2 | |
| C. | 用装置③陶瓷坩埚高温煅烧CaCO3固体 | |
| D. | 关闭活塞a,从b处加水,以检查装置④的气密性 |
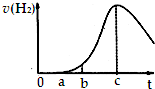 把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )
把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如图的坐标曲线来表示,则( )| A. | 曲线由0→a段发生了氧化还原反应 | |
| B. | 曲线由b→c段,产生氢气的速率增加较快的主要原因是反应放热 | |
| C. | c点达到了平衡 | |
| D. | c点以后,反应逐渐消耗了产生的氢气 |
| A. | 食盐和食醋 | B. | 食盐和纯碱 | C. | 纯碱和食醋 | D. | 全部 |
| A. | KSCN溶液 | B. | NaOH溶液 | C. | AgNO3溶液 | D. | 溶液BaCl2 |
| A. | NaCl晶体、BaSO4 | B. | 铜、二氧化硫 | ||
| C. | NaOH固体、CO2 | D. | 熔融的KNO3、硫酸溶液 |
| A. | H2SO4═2H++SO42- | B. | NaHCO3═Na++HCO3- | ||
| C. | Na2CO3═2Na++CO32- | D. | CH3COOH═H++CH3COO- |