题目内容
将CO2和C加入密闭容器中,在一定条件下发生反应:CO2(g)+C(s)?2CO(g),忽略固体体积,平衡时CO的体积分数(%)随温度和压强的变化如下表所示:
下列判断不正确的是( )
| 温度/℃ CO的体积分数/% 压强/MPa | 1.0 | 2.0 | 3.0 |
| 800 | 54.0 | a | b |
| 900 | c | 75.0 | d |
| 1000 | e | f | 80.0 |
| A、b<f |
| B、900℃,2.0MPa的转化率为60% |
| C、K(1000℃)=3.2 |
| D、K(1000℃)>K(800℃) |
考点:化学平衡的计算
专题:化学平衡专题
分析:A、同温下,增大压强,平衡逆向进行,平衡时CO的体积分数变小,故可知c>75.0>54.0>a>b,利用c>54.0可知同压下,升温平衡正向移动,即正反应为吸热反应,从而可知f>75.0>a>b,所以f>b;
B、在900℃、2.0MPa下,设的CO2起始量为amol,转化率为x,则平衡时CO的量为2ax,由题意得
=75%,解得x=0.6;
C、体积不知道,无法计算平衡常数;
D、结合前面分析知升温平衡正向移动,则平衡常数增大.
B、在900℃、2.0MPa下,设的CO2起始量为amol,转化率为x,则平衡时CO的量为2ax,由题意得
| 2ax |
| a-ax+2ax |
C、体积不知道,无法计算平衡常数;
D、结合前面分析知升温平衡正向移动,则平衡常数增大.
解答:
解:A、同温下,增大压强,平衡逆向进行,平衡时G的体积分数变小,故可知c>75.0>54.0>a>b,利用c>54.0可知同压下,升温平衡正向移动,即正反应为吸热反应,从而可知f>75.0>a>b,所以f>b,故A错误;
B、在900℃、2.0MPa下,设的CO2起始量为amol,转化率为x,则平衡时CO的量为2ax,由题意得
=75%,解得x=0.6,所以转化率为60%,故B正确;
C、体积不知道,无法计算平衡常数,故C错误;
D、根据A的分析,c>54.0可知同压下,升温平衡正向移动,即正反应为吸热反应,所以K(1000℃)>K(800℃),故D正确;
故选AC.
B、在900℃、2.0MPa下,设的CO2起始量为amol,转化率为x,则平衡时CO的量为2ax,由题意得
| 2ax |
| a-ax+2ax |
C、体积不知道,无法计算平衡常数,故C错误;
D、根据A的分析,c>54.0可知同压下,升温平衡正向移动,即正反应为吸热反应,所以K(1000℃)>K(800℃),故D正确;
故选AC.
点评:本题考查化学平衡影响因素分析,数据处理的方法应用,平衡计算和对比判断是解题关键,题目难度中等.

练习册系列答案
相关题目
图(1)废电池需要集中处理,主要原因是电池中含有的( )元素掺入生活垃圾中进行填埋时,会通过渗液污染水体和土壤.
| A、Al | B、Ag | C、Hg | D、Na |
化合物丙可由如下反应得到: ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )
 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )| A、CH3CH(CH2Br)2 |
| B、(CH3)2CBrCH2Br |
| C、C2H5CHBrCH2Br |
| D、CH3(CHBr)2CH3 |
在容积相等的两个密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol和b mol HI(a>b),发生反应2HI(g)?H2(g)+I2(g)达到平衡后,下列说法中,正确的是( )
| A、从开始反应到达平衡,所需时间tA>tB |
| B、平衡时,I2蒸气在混合气体中的体积分数φA>φB |
| C、平衡时,I2蒸气的物质的量浓度[I2]A=[I2]B |
| D、HI的平衡转化率,αA=αB |
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
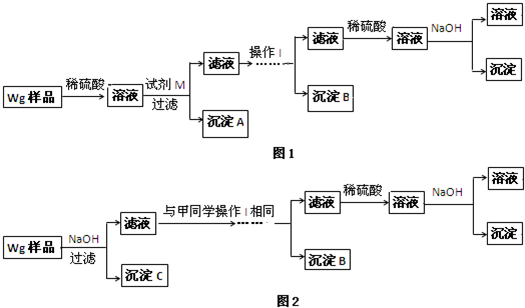
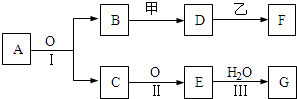
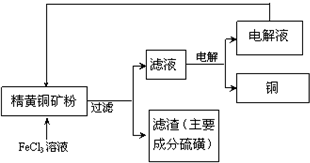 工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺.
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺.