题目内容
某混合金属粉末,除Fe外,还含有Al、Zn中的一种或两种,含量都在10%以上.某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在,探究过程如下:
【查阅资料】①Zn可以与NaOH溶液反应生成H2
②Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O
③Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸生成Zn2+、NH4+
【提出假设】假设①:该混合金属粉末中除Fe外还含有Al元素
假设②:该混合金属粉末中除Fe外还含有Zn元素
假设③:该混合金属粉末中除Fe外还含有Al、Zn元素
【实验探究】所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3?H2O.
甲同学基于假设③设计实验方案如图1:
乙同学同样基于假设③设计另一实验方案如图2:
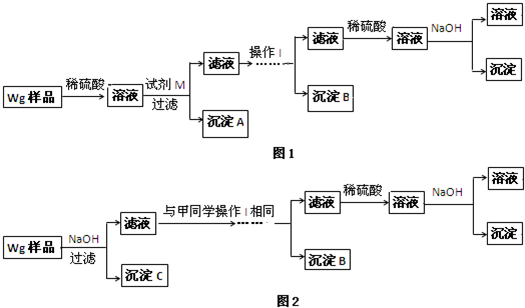
(1)Fe元素在周期表中的位置是第 周期 族.
(2)试剂M是 ;沉淀B是 .
(3)你认为甲、乙同学的方案 (填“甲”或“乙”)比较好,理由是 .
(4)操作Ⅰ的主要过程是:在滤液中逐滴加入 ,直至生成的沉淀刚好溶解,再加入足量的 .
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,你认为 (填“是”或“否”)准确,原因是 .
(6)电解法制金属铝的化学方程式是 .
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 .
【查阅资料】①Zn可以与NaOH溶液反应生成H2
②Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3?H2O
③Zn2+易形成络合物如[Zn(NH3)4]2+,该络合物遇强酸生成Zn2+、NH4+
【提出假设】假设①:该混合金属粉末中除Fe外还含有Al元素
假设②:该混合金属粉末中除Fe外还含有Zn元素
假设③:该混合金属粉末中除Fe外还含有Al、Zn元素
【实验探究】所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3?H2O.
甲同学基于假设③设计实验方案如图1:
乙同学同样基于假设③设计另一实验方案如图2:

(1)Fe元素在周期表中的位置是第
(2)试剂M是
(3)你认为甲、乙同学的方案
(4)操作Ⅰ的主要过程是:在滤液中逐滴加入
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,你认为
(6)电解法制金属铝的化学方程式是
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据Fe元素在周期表中的位置作答;
(2)根据甲同学基于假设③设计实验方案,样品加入酸之后生成了铁盐、铝盐和锌盐,铁盐加过量的强碱生成了沉淀不溶解,而铝盐和锌盐加过量的强碱先生成了沉淀然后沉淀溶解;而铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,锌盐加过量的弱碱先生成了沉淀然后沉淀溶解,由实验方案可知铁盐、铝盐和锌盐形成的沉淀分三次分离,第一次为:Fe(OH)3,试剂M为NaOH溶液,第二次为:Al(OH)3,铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)沉淀的分离;第三次为Zn(OH)2,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入适量的NaOH溶液,形成沉淀;
(3)根据对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸;
(4)铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)沉淀的分离;
(5)根据反应的先后顺序以及量的关系来分析;
(6)根据电解原理分析.
(2)根据甲同学基于假设③设计实验方案,样品加入酸之后生成了铁盐、铝盐和锌盐,铁盐加过量的强碱生成了沉淀不溶解,而铝盐和锌盐加过量的强碱先生成了沉淀然后沉淀溶解;而铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,锌盐加过量的弱碱先生成了沉淀然后沉淀溶解,由实验方案可知铁盐、铝盐和锌盐形成的沉淀分三次分离,第一次为:Fe(OH)3,试剂M为NaOH溶液,第二次为:Al(OH)3,铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)沉淀的分离;第三次为Zn(OH)2,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入适量的NaOH溶液,形成沉淀;
(3)根据对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸;
(4)铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)沉淀的分离;
(5)根据反应的先后顺序以及量的关系来分析;
(6)根据电解原理分析.
解答:
解:(1)Fe元素在周期表中的位置是第四周期第ⅥⅡ族,故答案为:四;ⅥⅡ;
(2)由实验方案可知铁盐、铝盐和锌盐形成的沉淀分三次分离,第一次为:Fe(OH)3,试剂M为NaOH溶液,第二次为:Al(OH)3,铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,实现了Al(OH)3沉淀的分离;第三次为Zn(OH)2,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入适量的NaOH溶液,形成沉淀,故答案为:NaOH溶液;Al(OH)3;
(3)对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸,故答案为:乙;步骤简单,节约试剂;
(4)铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)3沉淀的分离,故答案为:稀硫酸;稀氨水;
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,此数据不准确,C沉淀为氢氧化铁,经洗涤、烘干、冷却后得到为氧化铁,并非Fe的质量;故答案为:否;C沉淀为氢氧化铁,经洗涤、烘干、冷却后得到为氧化铁,并非Fe的质量;
(6)电解铝的反应方程式为2Al2O3(熔融)
4Al+3O2↑,电池反应的化学方程式是Al+3NiO(OH)+H2O+NaOH=3Ni(OH)2+NaAlO2,故答案为:2Al2O3(熔融)
4Al+3O2↑;Al+3NiO(OH)+H2O+NaOH=3Ni(OH)2+NaAlO2.
(2)由实验方案可知铁盐、铝盐和锌盐形成的沉淀分三次分离,第一次为:Fe(OH)3,试剂M为NaOH溶液,第二次为:Al(OH)3,铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,实现了Al(OH)3沉淀的分离;第三次为Zn(OH)2,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,再加入适量的NaOH溶液,形成沉淀,故答案为:NaOH溶液;Al(OH)3;
(3)对比甲、乙两同学的实验,发现甲比乙多了第一步加稀硫酸,故答案为:乙;步骤简单,节约试剂;
(4)铝盐和锌盐加过量的强碱先生成了沉淀,然后沉淀溶解,在滤液中逐滴加入稀硫酸,直至生成的沉淀刚好溶解,又形成了铝盐和锌盐,锌盐加过量的弱碱先生成了沉淀,然后沉淀溶解,铝盐加过量的弱碱也生成了沉淀,然后沉淀不溶解,这样实现了Al(OH)3沉淀的分离,故答案为:稀硫酸;稀氨水;
(5)乙同学将沉淀C洗涤、烘干、冷却后称重,质量为m1g,经计算即可得到样品中铁的质量分数,此数据不准确,C沉淀为氢氧化铁,经洗涤、烘干、冷却后得到为氧化铁,并非Fe的质量;故答案为:否;C沉淀为氢氧化铁,经洗涤、烘干、冷却后得到为氧化铁,并非Fe的质量;
(6)电解铝的反应方程式为2Al2O3(熔融)
| ||
| ||
点评:本题主要考查了金属的性质以及实验方案的设计,难度较大,尤其是锌及其化合物性质的运用.

练习册系列答案
相关题目
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、0.1mol?L-1Mg(NO3)2溶液中含有0.2nA个NO3- |
| B、8g CH4中含有10nA个电子 |
| C、常温常压下,22.4L O3中含有3nA个氧原子 |
| D、28g C2H4中含有2nA个碳原子 |
将CO2和C加入密闭容器中,在一定条件下发生反应:CO2(g)+C(s)?2CO(g),忽略固体体积,平衡时CO的体积分数(%)随温度和压强的变化如下表所示:
下列判断不正确的是( )
| 温度/℃ CO的体积分数/% 压强/MPa | 1.0 | 2.0 | 3.0 |
| 800 | 54.0 | a | b |
| 900 | c | 75.0 | d |
| 1000 | e | f | 80.0 |
| A、b<f |
| B、900℃,2.0MPa的转化率为60% |
| C、K(1000℃)=3.2 |
| D、K(1000℃)>K(800℃) |
 (1)a、b、c三点中醋酸的电离程度最大的是
(1)a、b、c三点中醋酸的电离程度最大的是
 Na2O2与水的反应实际可以分解为两个阶段:Na2O2+2H2O=2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2=2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际可以分解为两个阶段:Na2O2+2H2O=2NaOH+H2O2,反应放热,反应放出的热量使部分H2O2受热分解:2H2O2=2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验: