题目内容
某化学兴趣小组欲配制一定浓度的NaOH溶液,用来滴定未知浓度的盐酸,进而测定反应的中和热.请回答下列问题:
(1)配制0.55mo1?L-1的NaOH溶液250mL.
①先用托盘天平称量烧杯质量.称量前先调节天平零点.用“↓”表示在右盘上放置砝码,用“↑”表示从右盘上取下砝码.取用砝码情况和游码读数如下:烧杯的质量为 g.

②称量烧杯和NaOH固体的质量时,再在天平右盘上放置5g砝码,将游码的位置移到7g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡.
③以下是配制0.55mo1?L-1的NaOH溶液的过程示意图:

上述步骤的先后顺序是 → →A→D→ → → (填字母标号).
(2)中和滴定.
①量取0.55mo1?L-1的NaOH溶液20.00mL注入锥形瓶中,并加入2滴酚酞,用未知浓度
的盐酸进行滴定.洗净的滴定管在滴定前必须进行的操作是:
a.检验活塞是否漏水;
b. ;
c.加入未知浓度的盐酸,赶走尖嘴部分的气泡,调节起始读数.
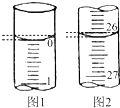
②该同学做了两次实验,所耗盐酸的体积如左图所示,则该盐酸的物质的量浓度为 .

③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的盐酸
物质的量浓度会 (填“偏高”、“偏低”或“不变”).
(3)中和热测定.
取上述50mL盐酸与50mL 0.55mol/L NaOH溶液在如上图右所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃用品是 _.
②烧杯间填满碎纸条是减少实验过程中的热量损失.③某同学做此实验所测数据如下:
(注:中和后生成的溶液的比热容C=4.18J?g-1?℃-1,溶液密度为1g/mL)
计算中和热△H=-55.176kJ/mol,中和热的理论值为△H=-57.3kJ/mol,造成该实验误差的原因可能是 .
A.小烧杯口高于大烧杯口
B.实验过程中动作缓慢
C.用环形铜制搅拌棒搅拌
D.倒入NaOH溶液后立即读取混合液的温度记为终止温度.
(1)配制0.55mo1?L-1的NaOH溶液250mL.
①先用托盘天平称量烧杯质量.称量前先调节天平零点.用“↓”表示在右盘上放置砝码,用“↑”表示从右盘上取下砝码.取用砝码情况和游码读数如下:烧杯的质量为

| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |
③以下是配制0.55mo1?L-1的NaOH溶液的过程示意图:

上述步骤的先后顺序是
(2)中和滴定.
①量取0.55mo1?L-1的NaOH溶液20.00mL注入锥形瓶中,并加入2滴酚酞,用未知浓度
的盐酸进行滴定.洗净的滴定管在滴定前必须进行的操作是:
a.检验活塞是否漏水;
b.
c.加入未知浓度的盐酸,赶走尖嘴部分的气泡,调节起始读数.
②该同学做了两次实验,所耗盐酸的体积如左图所示,则该盐酸的物质的量浓度为

③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的盐酸
物质的量浓度会
(3)中和热测定.
取上述50mL盐酸与50mL 0.55mol/L NaOH溶液在如上图右所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
①从实验装置上看,图中尚缺少的一种玻璃用品是
②烧杯间填满碎纸条是减少实验过程中的热量损失.③某同学做此实验所测数据如下:
| 实验次数 | 初始温度t1/℃ | 混合液最高温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 19.9 | 20.0 | 23.2 |
| 2 | 20.0 | 20.1 | 23.4 |
计算中和热△H=-55.176kJ/mol,中和热的理论值为△H=-57.3kJ/mol,造成该实验误差的原因可能是
A.小烧杯口高于大烧杯口
B.实验过程中动作缓慢
C.用环形铜制搅拌棒搅拌
D.倒入NaOH溶液后立即读取混合液的温度记为终止温度.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)①根据m物=m砝+m游来分析;
③依据配置一定物质的量浓度溶液的一般步骤判断操作的先后顺序;
(2)①依据中和滴定的实验过程解答即可;
②依据正确读数计算体积,利用中和反应原理计算即可;
③依据c=
分析即可;
(3)①为了溶液混合均匀,需使用搅拌器;
③依据实验过程判断误差即可.
③依据配置一定物质的量浓度溶液的一般步骤判断操作的先后顺序;
(2)①依据中和滴定的实验过程解答即可;
②依据正确读数计算体积,利用中和反应原理计算即可;
③依据c=
| n |
| V |
(3)①为了溶液混合均匀,需使用搅拌器;
③依据实验过程判断误差即可.
解答:
解:(1)①从图示可知,称量时所用砝码的质量为30g,游码的质量为3.2g,根据m物=m砝+m游可知烧杯的质量m=30g+3.2g=33.2g,故答案为:33.2;
③配置一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等,所以正确的操作顺序为:CBADGEF,
故答案为:C;B;G;E;F;
(2 )①滴定管使用前必须用未知浓度的盐酸润洗滴定管2~3次,故答案为:用未知浓度的盐酸润洗滴定管2~3次;
②依据两次读数可知:所耗盐酸的体积V=
=22.00mL,依据c(待测)═
=0.50 mo1?L-1,故答案为:0.50 mo1?L-1;
③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则所需的待测液体积偏大,故测定的盐酸浓度偏小,故答案为:偏低;
(3)①实验过程中为使得酸碱混合均匀,需使用环形搅拌器,故答案为:环形搅拌器;
③A.小烧杯口高于大烧杯口,不利于保温、隔热,造成误差,故正确;
B.实验过程中动作缓慢,此间造成热量损失,造成误差,故正确;
C.用环形铜制搅拌棒搅拌,铜制搅拌器吸热,造成误差,故正确;
D.倒入NaOH溶液后立即读取混合液的温度记为终止温度,此时不是最终温度,造成误差,故正确,
故选ABCD.
③配置一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶等,所以正确的操作顺序为:CBADGEF,
故答案为:C;B;G;E;F;
(2 )①滴定管使用前必须用未知浓度的盐酸润洗滴定管2~3次,故答案为:用未知浓度的盐酸润洗滴定管2~3次;
②依据两次读数可知:所耗盐酸的体积V=
| 22.00mL+22.00mL |
| 2 |
| 20.00mL×0.55mol/L |
| 22.00mL |
③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则所需的待测液体积偏大,故测定的盐酸浓度偏小,故答案为:偏低;
(3)①实验过程中为使得酸碱混合均匀,需使用环形搅拌器,故答案为:环形搅拌器;
③A.小烧杯口高于大烧杯口,不利于保温、隔热,造成误差,故正确;
B.实验过程中动作缓慢,此间造成热量损失,造成误差,故正确;
C.用环形铜制搅拌棒搅拌,铜制搅拌器吸热,造成误差,故正确;
D.倒入NaOH溶液后立即读取混合液的温度记为终止温度,此时不是最终温度,造成误差,故正确,
故选ABCD.
点评:本题考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.

练习册系列答案
相关题目
下列有关热化学方程式的叙述正确的是( )
| A、已知2H2(gO2(g)=2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B、已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D、已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 |
下列离子方程式中正确的是( )
| A、氯化亚铁溶液与过氧化钠2:1反应:6Fe2++3 Na2O2+6 H2O=4Fe(OH)3↓+6 Na++2Fe3+ |
| B、向氧化铁中加入氢碘酸发生反应:Fe2O3+6H++6 I -=2Fe2++3I2+3H2O |
| C、双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+O2↑+2 H2O |
| D、向银氨溶液中加入盐酸:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O |
加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,求混合物中碳酸钠的质量分数( )
| A、42% | B、58% |
| C、36% | D、64% |
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
 氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下:
氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下: