题目内容
下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是( )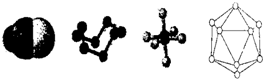

| A、已知单质硼的结构单元是由20个正三角形构成的正二十面体,则这个结构单元中含有30个B-B键、12个硼原子 |
| B、SF6为正八面体的非极性分子 |
| C、1 molHCN分子中有2 molσ键和2molπ键 |
| D、32gS8分子中含有0.125 molσ键 |
考点:共价键的形成及共价键的主要类型,极性分子和非极性分子
专题:
分析:A.根据晶胞的结构图可知,每个硼原子被5个正三角形共用,每个B-B被两个正三角形共用,利用均摊法解题;
B.根据SF6价层电子对数判断;
C.根据HCN的结构式及原子间的成键类型分析;
D.根据分子结构可知1molS8分子中含有8molσ键.
B.根据SF6价层电子对数判断;
C.根据HCN的结构式及原子间的成键类型分析;
D.根据分子结构可知1molS8分子中含有8molσ键.
解答:
解:A.根据晶胞的结构图可知,每个硼原子被5个正三角形共用,每个正三角形上有三个硼原子,所以这个基本结构单元含有硼原子的个数为:
=12,B-B键的个数为:
=30,故A正确;
B.SF6的价层电子对数为6,分子空间构型为正八面体,故B正确;
C.HCN的结构式为H-C≡N,H-C中含有1个σ键,C≡N中含有1个σ键和2个π键,所以1 molHCN分子中有2 molσ键和2molπ键,故C正确;
D.由分子结构可知1molS8分子中含有8molσ键,则32gS8分子中含有1molσ键,故D错误.
故选D.
| 20×3 |
| 5 |
| 20×3 |
| 2 |
B.SF6的价层电子对数为6,分子空间构型为正八面体,故B正确;
C.HCN的结构式为H-C≡N,H-C中含有1个σ键,C≡N中含有1个σ键和2个π键,所以1 molHCN分子中有2 molσ键和2molπ键,故C正确;
D.由分子结构可知1molS8分子中含有8molσ键,则32gS8分子中含有1molσ键,故D错误.
故选D.
点评:本题考查微粒的结构示意图(比例模型、球棍模型等),解题的关键是把握各原子间的成键情况,注意把握分子中σ键和π键的判断方法,题目难度中等.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
下列说法正确的是( )
| A、若溶液中c(OH-)=10-7 mol/L,则该溶液一定呈中性 |
| B、c(H+)越大,则pH越大,溶液的碱性越强 |
| C、pH=0的溶液,其中只含有H+,而无OH- |
| D、向25℃纯水中加少量NaHSO4(温度不变),c(H+)、c(OH-)乘积不变 |
下列有关热化学方程式的叙述正确的是( )
| A、已知2H2(gO2(g)=2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B、已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D、已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 |
CO2+NH3+H20+A═NaHCO3↓+NH4Cl是侯氏制碱法的重要反应,反应中物质A的化学式为( )
| A、Na2O |
| B、NaCl |
| C、NaOH |
| D、Na2CO3 |
下列离子方程式中正确的是( )
| A、氯化亚铁溶液与过氧化钠2:1反应:6Fe2++3 Na2O2+6 H2O=4Fe(OH)3↓+6 Na++2Fe3+ |
| B、向氧化铁中加入氢碘酸发生反应:Fe2O3+6H++6 I -=2Fe2++3I2+3H2O |
| C、双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+O2↑+2 H2O |
| D、向银氨溶液中加入盐酸:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O |
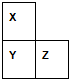 X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应.
X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应. 氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下:
氨与硝酸在工农业生产中均有重要的用途.某小组根据工业生产原理设计了生产氨与硝酸的主要过程如下: