题目内容
海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案:
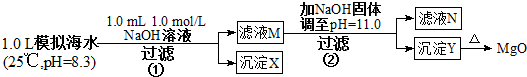
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;
实验过程中,假设溶液体积不变.
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12.
请回答下列问题:
(1)沉淀物X、Y分别为 、
(2)滤液M中存在离子 ,滤液N中存在的离子 (除了Na+、Cl-、H+、OH-以外).
(3)步骤①、②发生反应的所有离子方程式 、 .
(4)步骤②中若改为加入4.2g NaOH固体,沉淀物Y为 (通过列式计算说明).

| 模拟海水中的离 子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
实验过程中,假设溶液体积不变.
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12.
请回答下列问题:
(1)沉淀物X、Y分别为
(2)滤液M中存在离子
(3)步骤①、②发生反应的所有离子方程式
(4)步骤②中若改为加入4.2g NaOH固体,沉淀物Y为
考点:海水资源及其综合利用
专题:
分析:步骤①,加入0.001mol NaOH时,OH- 恰好与HCO3-完全反应,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3 沉淀,滤液M中同时存在着Ca2+和Mg2+;
步骤②,当滤液M中加入NaOH 固体,调至pH=11时,此时滤液中c(OH-)=1×10-3 mol?L-1.
根据溶度积可判断无Ca(OH)2生成,有Mg(OH)2沉淀生成;
根据溶度积可判断无Ca(OH)2生成,有Mg(OH)2沉淀生成,所以Y为Mg(OH)2;
步骤②,当滤液M中加入NaOH 固体,调至pH=11时,此时滤液中c(OH-)=1×10-3 mol?L-1.
根据溶度积可判断无Ca(OH)2生成,有Mg(OH)2沉淀生成;
根据溶度积可判断无Ca(OH)2生成,有Mg(OH)2沉淀生成,所以Y为Mg(OH)2;
解答:
解:(1)步骤①,从题给的条件,可知n(NaOH )=0.001mol,[即n(OH-)=0.001mol].
依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol NaOH时,OH- 恰好与HCO3-完全反应:OH-+HCO3-═CO32-+H2O,生成0.001molCO32-,由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3 沉淀Ca2++CO32-═CaCO3↓.所以沉淀物X为CaCO3;
当滤液M中加入NaOH 固体,调至pH=11(即pOH=3)时,此时滤液中c(OH-)=1×10-3 mol?L-1.
则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成;
Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成;
故答案为:CaCO3;Mg(OH)2;
(2)由于CO32-只有0.001mol,反应生成CaCO3 所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010 mol?L-1.滤液M中同时存在着Ca2+和Mg2+;由以上分析可知当滤液M中加入NaOH 固体,调至pH=11(即pOH=3)时,有Mg(OH)2沉淀生成;又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,所以Mg2+只存在M中;
故答案为:Ca2+和Mg2+;Ca2+;
(3)n(NaOH )=0.001mol,[即n(OH-)=0.001mol].依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol NaOH时,OH- 恰好与HCO3-完全反应:OH-+HCO3-=CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3 沉淀Ca2++CO32-=CaCO3↓.所以沉淀物X为CaCO3,滤液M中含有钠离子、钙离子、镁离子,若使Y为纯净物,则沉淀Y是氢氧化镁,反应是氢氧化钠和海水中的镁离子反应生成氢氧化镁沉淀,离子方程式为Mg2++2OH-=Mg(OH)2↓;
故答案为:HCO3-+Ca2++OH-=CaCO3↓+H2O;Mg2++2OH-=Mg(OH)2↓;
(4)步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:Mg2++2OH-═Mg(OH)2↓,生成0.05 mol Mg(OH)2,剩余0.005 mol OH-,由于Q[Ca(OH)2]=c(Ca2+)×c(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀;
故答案为:Mg(OH)2 .
依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol NaOH时,OH- 恰好与HCO3-完全反应:OH-+HCO3-═CO32-+H2O,生成0.001molCO32-,由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3 沉淀Ca2++CO32-═CaCO3↓.所以沉淀物X为CaCO3;
当滤液M中加入NaOH 固体,调至pH=11(即pOH=3)时,此时滤液中c(OH-)=1×10-3 mol?L-1.
则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成;
Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成;
故答案为:CaCO3;Mg(OH)2;
(2)由于CO32-只有0.001mol,反应生成CaCO3 所消耗的Ca2+也只有0.001mol,滤液中还剩余c(Ca2+)=0.010 mol?L-1.滤液M中同时存在着Ca2+和Mg2+;由以上分析可知当滤液M中加入NaOH 固体,调至pH=11(即pOH=3)时,有Mg(OH)2沉淀生成;又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,所以Mg2+只存在M中;
故答案为:Ca2+和Mg2+;Ca2+;
(3)n(NaOH )=0.001mol,[即n(OH-)=0.001mol].依据离子反应“先中和、后沉淀、再其他”的反应规律,当1L模拟海水中,加入0.001mol NaOH时,OH- 恰好与HCO3-完全反应:OH-+HCO3-=CO32-+H2O,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3 沉淀Ca2++CO32-=CaCO3↓.所以沉淀物X为CaCO3,滤液M中含有钠离子、钙离子、镁离子,若使Y为纯净物,则沉淀Y是氢氧化镁,反应是氢氧化钠和海水中的镁离子反应生成氢氧化镁沉淀,离子方程式为Mg2++2OH-=Mg(OH)2↓;
故答案为:HCO3-+Ca2++OH-=CaCO3↓+H2O;Mg2++2OH-=Mg(OH)2↓;
(4)步骤②中若改为加入4.2 g NaOH固体,则n(NaOH)=0.105mol,与0.05mol Mg2+反应:Mg2++2OH-═Mg(OH)2↓,生成0.05 mol Mg(OH)2,剩余0.005 mol OH-,由于Q[Ca(OH)2]=c(Ca2+)×c(OH-)2=0.010×(0.005)2=2.5×10-7<Ksp[Ca(OH)2],所以无Ca(OH)2沉淀析出,沉淀物Y为Mg(OH)2沉淀;
故答案为:Mg(OH)2 .
点评:本题考查了离子浓度及Ksp的有关计算,要求考生定量地分析发生的反应,溶液中存在的离子,推断沉淀是否产生,从而得出正确的结论.计算强调了实用性以及认识、解决问题的综合性,题目难度中等.

练习册系列答案
相关题目
下列有关电解质溶液中微粒的物质的量浓度的关系正确的是( )
| A、向0.1 mol?L-1NH4 Cl溶液中通入一定量氨气:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)<c(Cl-) |
| C、已知Ka(HF)=7.2×10-4,Ka(HCN)=4.9×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D、浓度均为0.1mol?L-l的三种溶液中:①(NH4)2CO3、②(NH4)2 SO4、③(NH4)2Fe(SO4)2,c(NH4+)的大小顺序为:③>②>① |
在一恒容密闭烧瓶中注入NO2,在25℃时建立平衡:2NO2?N2O4△H<0.若把烧瓶置于100℃的沸水中,下列情况:①颜色 ②平均摩尔质量 ③质量 ④压强 ⑤密度中不变的是( )
| A、③⑤ | B、③④ | C、②④ | D、①③ |
下列有关热化学方程式的叙述正确的是( )
| A、已知2H2(gO2(g)=2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B、已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D、已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 |
CO2+NH3+H20+A═NaHCO3↓+NH4Cl是侯氏制碱法的重要反应,反应中物质A的化学式为( )
| A、Na2O |
| B、NaCl |
| C、NaOH |
| D、Na2CO3 |
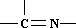 三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是