题目内容
将20mL0.4mol?L-1硝酸铵溶液跟50mL0.1mol?L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
| A、[NO3-]>[OH-]>[NH4+]>[Ba2+] |
| B、[NO3-]>[Ba2+]>[OH-]>[NH4+] |
| C、[Ba2+]>[NO3-]>[OH-]>[NH4+] |
| D、[NO3-]>[Ba2+]>[NH4+]>[OH-] |
考点:离子浓度大小的比较
专题:
分析:先计算硝酸铵和氢氧化钡的物质的量,再利用硝酸铵和氢氧化钡的反应来分析反应后所得溶液中各种离子的物质的量的多少,最后判断混合溶液中各离子浓度的大小.
解答:
解:20mL 0.4mol/L硝酸铵溶液中硝酸铵的物质的量为20mL×10-3L×0.4mol/L=0.008mol,
50mL 0.1mol/L氢氧化钡溶液中氢氧化钡的物质的量为50mL×10-3L×0.1mol/L=0.005mol,
硝酸铵和氢氧化钡混合以后发生反应:2NH4NO3+Ba(OH)2=Ba(NO3)2+2NH3?H2O,
则反应后,70ml溶液的组成为:剩余氢氧化钡0.001mol,生成的硝酸钡0.004mol,生成的一水合氨0.008mol,
在体积一样的前提下,物质的量越大,浓度越大,故[NO3-]>[Ba2+],
而氨水能电离出少量且相等的铵根和氢氧根,氢氧化钡中还有0.002mol的氢氧根,所以[OH-]>[NH4+],
故离子浓度大小顺序为:[NO3-]>[Ba2+]>[OH-]>[NH4+],
故选B.
50mL 0.1mol/L氢氧化钡溶液中氢氧化钡的物质的量为50mL×10-3L×0.1mol/L=0.005mol,
硝酸铵和氢氧化钡混合以后发生反应:2NH4NO3+Ba(OH)2=Ba(NO3)2+2NH3?H2O,
则反应后,70ml溶液的组成为:剩余氢氧化钡0.001mol,生成的硝酸钡0.004mol,生成的一水合氨0.008mol,
在体积一样的前提下,物质的量越大,浓度越大,故[NO3-]>[Ba2+],
而氨水能电离出少量且相等的铵根和氢氧根,氢氧化钡中还有0.002mol的氢氧根,所以[OH-]>[NH4+],
故离子浓度大小顺序为:[NO3-]>[Ba2+]>[OH-]>[NH4+],
故选B.
点评:本题考查学生溶液混合以后离子浓度大小比较,题目难度中等,是现在高考的热点和难点,明确反应后的混合液中各组分浓度为解答关键,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
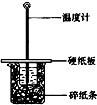 某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )
某实验小组学生按照课本实验要求,用50mL0.5mol/L的盐酸50mL0.5mol/L的NaOH溶液在如图所示的装置中进行中和反应通过测定反应过程中所放出的热量计算中和热.下列说法正确是( )| A、实验过程中没有热量损失 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是固定小烧杯 |
| D、若改用60 mL 0.50 mol/L盐酸跟50 mL 0.5 mol/L的 NaOH溶液进行反应,从理论上说所求中和热不相等 |
有BaCl2和NaCl的混合溶液a L,将其分成两等份.一份滴加稀硫酸,使Ba2+完全沉淀,另一份滴加AgNO3溶液,使Cl-完全沉淀.反应中分别消耗b mol的H2SO4和c mol的AgNO3.据此得知原混合溶液中的Na+的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列有关电解质溶液中微粒的物质的量浓度的关系正确的是( )
| A、向0.1 mol?L-1NH4 Cl溶液中通入一定量氨气:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)<c(Cl-) |
| C、已知Ka(HF)=7.2×10-4,Ka(HCN)=4.9×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 |
| D、浓度均为0.1mol?L-l的三种溶液中:①(NH4)2CO3、②(NH4)2 SO4、③(NH4)2Fe(SO4)2,c(NH4+)的大小顺序为:③>②>① |
误食重金属盐会引起中毒,下列不能用于解毒的措施是( )
| A、服大量鸡蛋清 |
| B、喝大量豆浆 |
| C、喝大量牛奶 |
| D、喝食盐水 |
下列说法正确的是( )
| A、若溶液中c(OH-)=10-7 mol/L,则该溶液一定呈中性 |
| B、c(H+)越大,则pH越大,溶液的碱性越强 |
| C、pH=0的溶液,其中只含有H+,而无OH- |
| D、向25℃纯水中加少量NaHSO4(温度不变),c(H+)、c(OH-)乘积不变 |
下列有关热化学方程式的叙述正确的是( )
| A、已知2H2(gO2(g)=2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B、已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(aq);△H=-57.4 kJ/mol |
| D、已知2C(s)+2O2(g)=2CO2(g);△H1,2C(s)+O2(g)=2CO(g);△H2.则△H1<△H2 |
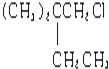 ,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示:
,B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示: