题目内容
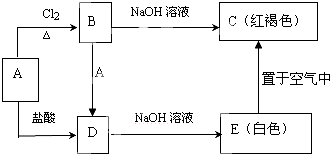 某金属A及其化合物之间有如下转化关系.
某金属A及其化合物之间有如下转化关系.请回答下列问题.
(1)A的化学式为
(2)A 与盐酸反应的离子方程式为
(3)若D的水溶液中含有B,如何除去,用离子方程式说明
(4)设计实验检验B的水溶液中阳离子的方法是
(5)写出氯气的两种用途
考点:无机物的推断
专题:
分析:红褐色C为Fe(OH)3,根据元素守恒可知金属A为Fe,与氯气反应得到B为FeCl3,Fe与盐酸反应得到D,D与NaOH溶液得到E,E在空气中得到C,则D为FeCl2、E为Fe(OH)2,据此解答.
解答:
解:红褐色C为Fe(OH)3,根据元素守恒可知金属A为Fe,与氯气反应得到B为FeCl3,Fe与盐酸反应得到D,D与NaOH溶液得到E,E在空气中得到C,则D为FeCl2、E为Fe(OH)2,
(1)由上述分析可知,A为Fe,B为Fe(OH)2,故答案为:Fe;Fe(OH)2;
(2)铁与盐酸反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(3)FeCl2中混有FeCl3,可以用Fe来还原三价铁离子,反应的离子方程式为:Fe+2Fe3+=2Fe2+;故答案为:Fe+2Fe3+=2Fe2+;
(4)若要检验B中的阳离子,可选用KSCN溶液,现象是:滴加KSCN溶液后,溶液变为红色,故答案为:滴加KSCN溶液后,溶液变红色;
(5)氯气是一种有着广泛用途的重要化工原料,可用于制盐酸、漂白粉、有机溶剂与多种农药,故答案为:制盐酸、漂白粉.
(1)由上述分析可知,A为Fe,B为Fe(OH)2,故答案为:Fe;Fe(OH)2;
(2)铁与盐酸反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(3)FeCl2中混有FeCl3,可以用Fe来还原三价铁离子,反应的离子方程式为:Fe+2Fe3+=2Fe2+;故答案为:Fe+2Fe3+=2Fe2+;
(4)若要检验B中的阳离子,可选用KSCN溶液,现象是:滴加KSCN溶液后,溶液变为红色,故答案为:滴加KSCN溶液后,溶液变红色;
(5)氯气是一种有着广泛用途的重要化工原料,可用于制盐酸、漂白粉、有机溶剂与多种农药,故答案为:制盐酸、漂白粉.
点评:本题考查无机物推断,涉及Fe元素单质化合物性质,C为红褐色是推断突破口,难度不大,注意对基础知识的掌握.

练习册系列答案
相关题目
0.1mol有机物A恰好与标准状况下4.48LHCl发生加成反应,得到产物B,该产物最多与0.4mol Cl2在光照条件下发生取代反应,则有机物A可能为( )
| A、C2H2 |
| B、C2H4 |
| C、C2H6 |
| D、C3H6 |
除去某物质里混有的少量杂质,下列做法中不正确的是(括号内的物质为杂质)( )
| A、KNO3溶液(AgNO3):加足量KCl溶液后过滤. |
| B、NaCl溶液(Na2CO3):加足量盐酸后加热. |
| C、KNO3固体(NaCl):溶解后加热蒸发得浓溶液,降温结晶后过滤. |
| D、NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热. |
下列说法不正确的是( )
| A、△H<0、△S>0的反应在任何温度下都能自发进行 |
| B、NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ?mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C、因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
| D、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
 热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H),图为氧族元素氢化物a、b、c、d的生成热数据示意图,(氧族元素包括氧、硫、硒、碲).试完成下列问题:
热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H),图为氧族元素氢化物a、b、c、d的生成热数据示意图,(氧族元素包括氧、硫、硒、碲).试完成下列问题: