题目内容
 热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H),图为氧族元素氢化物a、b、c、d的生成热数据示意图,(氧族元素包括氧、硫、硒、碲).试完成下列问题:
热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H),图为氧族元素氢化物a、b、c、d的生成热数据示意图,(氧族元素包括氧、硫、硒、碲).试完成下列问题:(1)根据焓变数据可以确定a代表的元素是?
(2)硒化氢(H2Se)在上述条件下发生分解反应的热化学反应方程式
考点:反应热和焓变
专题:
分析:(1)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系可判断;
(2)根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.
(2)根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.
解答:
解:(1)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为Te、Se、S、O.故答案为:碲;
(2)由图可知,b为H2Se的生成热数据,则H2Se分解放热,且△H=-81kJ/mol,
所以H2Se发生分解反应的热化学反应方程式为H2Se(g)═Se(s)+H2(g)△H=-81 kJ?mol-1,
故答案为:H2Se(g)═Se(s)+H2(g)△H=-81 kJ?mol-1.
(2)由图可知,b为H2Se的生成热数据,则H2Se分解放热,且△H=-81kJ/mol,
所以H2Se发生分解反应的热化学反应方程式为H2Se(g)═Se(s)+H2(g)△H=-81 kJ?mol-1,
故答案为:H2Se(g)═Se(s)+H2(g)△H=-81 kJ?mol-1.
点评:本题考查化学反应与能量变化,题目难度不大,本题注意从图象判断各种氢化物的种类为解答该题的关键.

练习册系列答案
相关题目
IBr的化学性质与卤素单质相似,能与金属反应生成金属卤化物,也可以与水发生如下反应:IBr+H2O=HIO+HBr 下列说法正确的是( )
| A、在IBr中,碘和溴的化合价均为零 |
| B、IBr与水反应时,IBr既是氧化剂又是还原剂 |
| C、IBr与钾反应,化学方程式是2K+IBr=KI+KBr |
| D、IBr与Ca(OH)2溶液反应,产物有CaI2、Ca(BrO)2和H2O |
定容容器A与定压容器B的体积开始时相同,内皆装有同质量、同物质的量之比的SO2与O2混合气体,经一定时间在相同温度下达到平衡.有关叙述正确的是( )
| A、A、B中SO2的转化率相同 |
| B、B中的反应速率比A中快 |
| C、A中SO2的转化率比B中高 |
| D、若A、B中皆再加入同量的氩气,平衡不移动 |
下列化合物中价键极性最小是( )
| A、MgCl2 |
| B、AlCl3 |
| C、SiCl4 |
| D、PCl5 |
在周期表主族元素中,X元素位于第二周期,且分别与Y、Z、W三种元素相邻,X、Y的原子序数之和等于Z的原子序数;这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A、原子序数:Z>W>X>Y |
| B、X、Y、Z、W形成的单质最多有6种 |
| C、X元素最高价氧化物对应水化物的化学式为:HXO3 |
| D、四种元素的气态氢化物中,W的气态氢化物最稳定 |
化肥和农药对农牧业的增产增收起重要作用,但使用不当也会给人类和环境带来危害.下列关化肥或农药的使用描述不正确的是( )
| A、(NH4)2SO4的大量使用可能造成土壤的碱化 |
| B、磷肥的大量使用可能造成水体富营养化 |
| C、农药的使用可能影响害虫与其天敌之间的生态平衡 |
| D、家蚕吞食喷洒过农药的桑叶,可能引起中毒 |

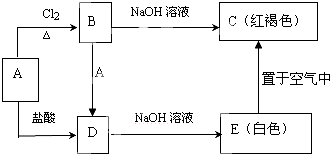 某金属A及其化合物之间有如下转化关系.
某金属A及其化合物之间有如下转化关系. 某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动.
某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动.