题目内容
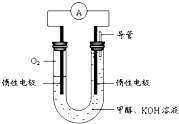
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图1所示.请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 .
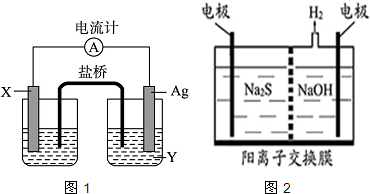
(3)硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.(1)将烧碱吸收H2S后的溶液加入到如图2所示的电解池的阳极区进行电解.电解过程中阳极区发生如下反应:S2--2e-═S
(n-1)S+S2-═Sn2-
①写出电解时阴极的电极反应式:
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 .
(1)电极X的材料是
(2)银电极为电池的
(3)硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.(1)将烧碱吸收H2S后的溶液加入到如图2所示的电解池的阳极区进行电解.电解过程中阳极区发生如下反应:S2--2e-═S
(n-1)S+S2-═Sn2-
①写出电解时阴极的电极反应式:
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成

考点:原电池和电解池的工作原理
专题:
分析:(1)根据电池反应式知,失电子化合价升高的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的化合价降低的可溶性反应物作电解质溶液,据此设计原电池;
(2)原电池中,易失电子的电极铜为负极,银作正极,正极上得电子发生还原反应;
(3)①阴极上氢离子放电生成氢气,阳极上硫离子放电,电极反应式为S2--2e-═S;
②Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S.
(2)原电池中,易失电子的电极铜为负极,银作正极,正极上得电子发生还原反应;
(3)①阴极上氢离子放电生成氢气,阳极上硫离子放电,电极反应式为S2--2e-═S;
②Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S.
解答:
解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,所以X电极材料是Cu,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3溶液;
(2)正极为活泼性较弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-═Ag,X电极材料是Cu,Cu失电子生成铜离子,电极反应式为:Cu-2e-═Cu2+,
故答案为:正极; Ag++e-═Ag(或2Ag++2e-═2Ag);Cu-2e-═Cu2+;
(3)①阳极上硫离子放电,电极反应式为S2--2e-═S,阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,故答案为:Sn2-+2H+=(n-1)S↓+H2S↑;
故答案为:Cu;AgNO3溶液;
(2)正极为活泼性较弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e-═Ag,X电极材料是Cu,Cu失电子生成铜离子,电极反应式为:Cu-2e-═Cu2+,
故答案为:正极; Ag++e-═Ag(或2Ag++2e-═2Ag);Cu-2e-═Cu2+;
(3)①阳极上硫离子放电,电极反应式为S2--2e-═S,阴极上氢离子放电生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
②电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,故答案为:Sn2-+2H+=(n-1)S↓+H2S↑;
点评:本题考查了原电池和电解池的工作原理,注意电极反应式的书写,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
钢铁制品表面镀铝既美观又能防腐.镀铝时选用的阳极材料是( )
| A、Zn |
| B、Fe |
| C、Al |
| D、AlCl3 |
IBr的化学性质与卤素单质相似,能与金属反应生成金属卤化物,也可以与水发生如下反应:IBr+H2O=HIO+HBr 下列说法正确的是( )
| A、在IBr中,碘和溴的化合价均为零 |
| B、IBr与水反应时,IBr既是氧化剂又是还原剂 |
| C、IBr与钾反应,化学方程式是2K+IBr=KI+KBr |
| D、IBr与Ca(OH)2溶液反应,产物有CaI2、Ca(BrO)2和H2O |
定容容器A与定压容器B的体积开始时相同,内皆装有同质量、同物质的量之比的SO2与O2混合气体,经一定时间在相同温度下达到平衡.有关叙述正确的是( )
| A、A、B中SO2的转化率相同 |
| B、B中的反应速率比A中快 |
| C、A中SO2的转化率比B中高 |
| D、若A、B中皆再加入同量的氩气,平衡不移动 |
在周期表主族元素中,X元素位于第二周期,且分别与Y、Z、W三种元素相邻,X、Y的原子序数之和等于Z的原子序数;这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A、原子序数:Z>W>X>Y |
| B、X、Y、Z、W形成的单质最多有6种 |
| C、X元素最高价氧化物对应水化物的化学式为:HXO3 |
| D、四种元素的气态氢化物中,W的气态氢化物最稳定 |
 将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2 (g)?2HI(g);△H<0,并达平衡.HI的物质的量分数w(HI)随时间变化如图曲线(Ⅱ)所示:
将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2 (g)?2HI(g);△H<0,并达平衡.HI的物质的量分数w(HI)随时间变化如图曲线(Ⅱ)所示:
 某金属A及其化合物之间有如下转化关系.
某金属A及其化合物之间有如下转化关系.