题目内容
18.关于下列装置说法正确的是( )| A. | 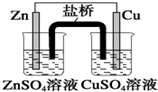 装置中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 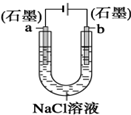 装置工作一段时间后,a极附近溶液的pH增大 | |
| C. | 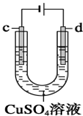 用装置精炼铜时,c极为精铜,电解过程中CuSO4溶液没有变化 | |
| D. | 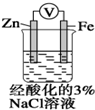 装置中电子由Zn流向Fe,装置中有Fe2+生成 |
分析 A.原电池工作时,阳离子向正极移动;
B.a为阴极,产生氢氧化钠;
C.粗铜中含铁、镍等,失电子发生氧化反应,硫酸铜溶液浓度略降低;
D.锌比铁活泼,锌作负极,铁被保护.
解答 解:A.原电池工作时,阳离子向正极移动,锌为负极,铜为正极,盐桥中的K+移向CuSO4溶液,故A错误;
B.a为与电源负极相连是阴极,氢离子得电子发生还原反应生成氢气,破坏水的电离平衡,氢氧根浓度增大,碱性增强,PH值增大,故B正确;
C.粗铜为阳极,失电子发生氧化反应,但粗铜中含铁、镍等,这些金属在阳极失电子产生金属阳离子进入溶液,在阴极只有铜离子得电子产生铜,根据得失电子守恒可知,阳极失电子的铜小于阴极得电子的铜的量,原溶液中有铜离子析出,则硫酸铜溶液浓度略降低,故C错误;
D.锌比铁活泼,锌作负极,电子从负极锌流出经导线流向正极铁,铁被保护,不可能产生二价铁离子,故D错误;
故选B.
点评 本题考查较为综合,涉及原电池与电解池等知识,综合考查学生的分析能力、实验能力,注意把握原电池和电解池的工作原理以及电极的变化,难度不大.

练习册系列答案
相关题目
8.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
①2Fe2++H2O2+2H+=2Fe3++2H2O
②2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法不正确的是( )
①2Fe2++H2O2+2H+=2Fe3++2H2O
②2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法不正确的是( )
| A. | H2O2在反应①中作氧化剂,在反应②中作还原剂 | |
| B. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| C. | 在H2O2分解过程中,Fe2+起到催化剂的作用 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
9.下列解释事实的方程式不正确的是( )
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:CaSO4+CO32-═CaCO3+SO42- | |
| D. | 向5 mL 0.1 mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
3.汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,则下列说法正确的是( )
| A. | KNO3是还原剂,其中N元素被氧化 | |
| B. | 生成物中的N2是氧化产物,K2O是还原产物 | |
| C. | 当氧化产物比还原产物多2.8g时,转移电子$\frac{1}{14}$ mol | |
| D. | 氧化剂与还原剂的物质的量之比5:1 |
10.下列分离方法不合理的是( )
| A. | 从石油中得到各成分,可用蒸馏的方法,蒸馏为物理方法 | |
| B. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| C. | 只含有泥沙的粗盐,可通过溶解、过滤、结晶的方法提纯 | |
| D. | 储存FeCl2溶液,需向试剂瓶中加入一定量的铁屑 |
7.若20g密度为ρg•cm-3的硝酸钙溶液里含1g Ca2+,则NO3-的物质的量浓度是( )
| A. | ρ400mol•L-1 | B. | 20ρmol•L-1 | C. | 2.5ρmol•L-1 | D. | 1.25ρmol•L-1 |
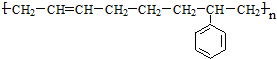

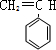 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$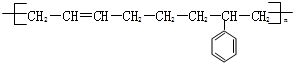 .
. W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.
W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.