题目内容
4. W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.
W、X、Y、Z 是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10,X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的吸引电子的能力在同周期主族元素中最大.请回答下列问题:
(1)X元素位于元素周期表中第三周期ⅠA族;W元素与氢元素形成的原子个数之比为1:1的化合物的分子式为H2O2
(2)X的单质和Y的单质相比,熔点较高的是Si(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式).
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是:SiCl4+3H2O=H2SiO3↓+4HCl.
分析 W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,则W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,则X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的吸引电子的能力在同周期主族元素中最大,说明Z在同周期中非金属性最强,结合Z的原子序数大于Na,且为短周期元素可知,Z为Cl元素,据此进行解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的吸引电子的能力在同周期主族元素中最大,说明Z在同周期中非金属性最强,结合Z的原子序数大于Na,且为短周期元素可知,Z为Cl元素,
(1)X为Na元素,位于元素周期表中第三周期第IA族;W为O元素,O与H形成原子个数比1:1的物质为H2O2,
故答案为:三;IA;H2O2;
(2)X单质为钠,属于金属晶体,其熔点比较低,Y的单质为硅,属于原子晶体,则Si的沸点高于Na;z为Cl元素,由于非金属性Cl>Br,故氢化物稳定性:HCl>HBr,
故答案为:Si;HCl;
(3)Y和Z形成的化合物为SiCl4,SiCl4和足量的水反应生成一种弱酸和一种强酸,应得到硅酸与HCl,该反应的化学方程式为:SiCl4+3H2O=H2SiO3↓+4HCl,
故答案为:SiCl4+3H2O=H2SiO3↓+4HCl.
点评 本题考查位置结构性质关系应用,题目难度中等,推断元素是解题关键,侧重对化学用语与元素周期律的考查,有利于学生对基础知识的巩固,注意熟练掌握原子结构与元素周期律、元素周期表的关系.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | 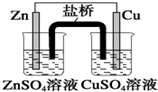 装置中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 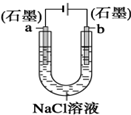 装置工作一段时间后,a极附近溶液的pH增大 | |
| C. | 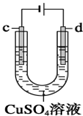 用装置精炼铜时,c极为精铜,电解过程中CuSO4溶液没有变化 | |
| D. | 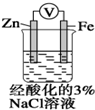 装置中电子由Zn流向Fe,装置中有Fe2+生成 |
| A. | 8.5 g | B. | 10.8 g | C. | 6.2 g | D. | 4.6 g |
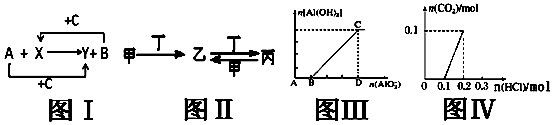
| A. | 关于图Ⅰ,已知C是氧气,X、Y是化合物,则A是钠,B是氢气 | |
| B. | 关于图Ⅱ,已知甲、乙、丙均含有相同的某种元素,若甲为NaOH溶液,则丁可能是CO2 | |
| C. | 关于图Ⅲ,表示NaAlO2溶液逐滴加入到NaOH溶液中,n(Al(OH)3)和n(AlO2-)之间的关系图象 | |
| D. | 关于图Ⅳ,表示各含0.1mol苏打和NaOH混合液中逐滴加入含溶质0.2mol的盐酸的关系图象 |
| A. | 2-乙基丁烷 | B. | 3,4-二甲基丁烷 | ||
| C. | 2,3,3-三甲基丁烷 | D. | 3-甲基-1-丁烯 |
| A. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol--1,则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知2C(s)+2O2(g)=2CO2(g)△H=a,2C(s)+O2(g)=2CO(g)△H=b,则a>b | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ | |
| D. | 已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定 |
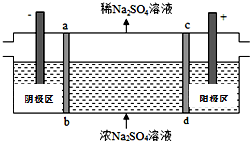 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )| A. | 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强 | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 阴极区溶液pH降低,阳极区溶液pH升高 | |
| D. | 当电路中通过1mol电子的电量时,会有0.5mol的O2生成 |
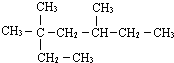 的系统命名法的名称3,3,5,-三甲基庚烷
的系统命名法的名称3,3,5,-三甲基庚烷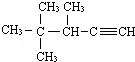 的系统命名法的名称为3,4,4-三甲基-1-戊炔.
的系统命名法的名称为3,4,4-三甲基-1-戊炔. .
.