题目内容
3.汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,则下列说法正确的是( )| A. | KNO3是还原剂,其中N元素被氧化 | |
| B. | 生成物中的N2是氧化产物,K2O是还原产物 | |
| C. | 当氧化产物比还原产物多2.8g时,转移电子$\frac{1}{14}$ mol | |
| D. | 氧化剂与还原剂的物质的量之比5:1 |
分析 10NaN3+2KNO3═K2O+5Na2O+16N2↑,NaN3氮元素化由-$\frac{1}{3}$升高到N2中的0价,是还原剂,发生氧化反应,对应氧化产物;2KNO3中氮化合价由+5降低到N2 中的0价,是氧化剂,发生还原反应,对应还原产物,据此解答.
解答 解:A.KNO3中氮化合价由+5降低到N2中的0价,是氧化剂,故A错误;
B.NaN3氮元素化由-$\frac{1}{3}$升高到N2中的0价,是还原剂,发生氧化反应,则N2为氧化产物;2KNO3中氮化合价由+5降低到N2 中的0价,是氧化剂,发生还原反应,则N2为还原产物,故B错误;
C.若氧化产物比还原产物多2.8g,即0.1mol时,由反应可知,生成16molN2时氧化产物比还原产物多14mol,则转移电子为10mol,则当氧化产物比还原产物多2.8g时,转移电子$\frac{10mol×0.1}{14}$=$\frac{1}{14}$ mol,故C正确;
D.该反应中10molNaN3是还原剂,2molKNO3是氧化剂,则氧化剂与还原剂的物质的量之比1:5,故D错误;
故选C.
点评 本题考查了氧化还原反应相关的概念以及计算,属于基础知识考查,明确发生的反应及反应中元素的化合价变化即可解答,题目难度不大.

练习册系列答案
相关题目
18.关于下列装置说法正确的是( )
| A. | 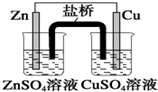 装置中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 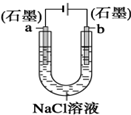 装置工作一段时间后,a极附近溶液的pH增大 | |
| C. | 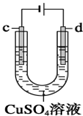 用装置精炼铜时,c极为精铜,电解过程中CuSO4溶液没有变化 | |
| D. | 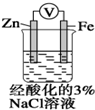 装置中电子由Zn流向Fe,装置中有Fe2+生成 |
8.下列离子方程式表达正确的是( )
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 硫酸铝溶液中加入偏铝酸钠溶液:Al3++3AlO2-+6H2O=4Al(OH)3↓ | |
| C. | FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ | |
| D. | 氯化铝溶液中加入过量氨水Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
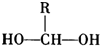 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$ 请根据图作答:
请根据图作答: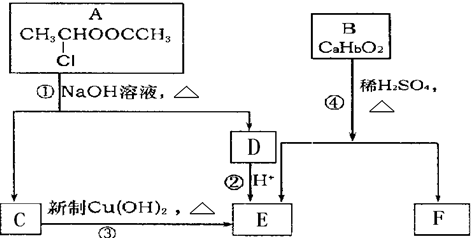

 、
、 、
、 、
、 .
.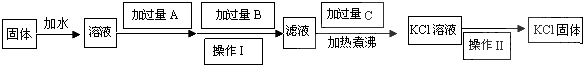
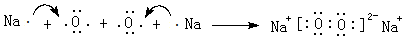 ,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
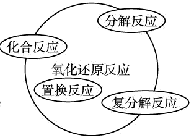
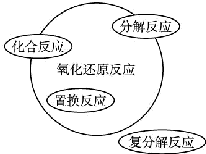
,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.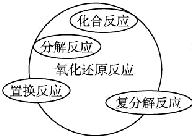

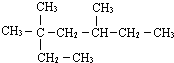 的系统命名法的名称3,3,5,-三甲基庚烷
的系统命名法的名称3,3,5,-三甲基庚烷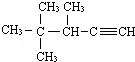 的系统命名法的名称为3,4,4-三甲基-1-戊炔.
的系统命名法的名称为3,4,4-三甲基-1-戊炔. .
.