题目内容
6.NA表示阿伏加德罗常数.下列说法正确的是( )| A. | 标准状态下,33.6 L氟化氢中含有1.5 NA个氟化氢分子 | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| C. | 1molNaCl晶体中含有NA个Na+ | |
| D. | 28g乙烯分子中含有极性共价键的数目为6NA |
分析 A.标况下HF为液体;
B.苯环中不含碳碳双键;
C.1mol氯化钠电离产生1mol钠离子和1mol氯离子;
D.乙烯的相对分子质量为28,依据分子中含有4个C-H价和1个C=C键;
解答 解:A.标况下HF为液体,不能使用气体摩尔体积,故A错误;
B.苯环中不含碳碳双键,1mol苯乙烯中含有的碳碳双键数为NA,故B错误;
C.1mol氯化钠电离产生1mol钠离子和1mol氯离子,故C正确;
D.28g乙烯分子物质的量为1mol,1mol乙烯中含有4mol极性共价键,共价键数目为4NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数,做题时注意物质的状态、存在的条件、有机物结构,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
17.短周期元素X、Y、Z、W、Q在周期表中的相对位置如图所示.下列说法不正确的是( )
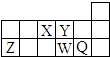

| A. | 离子半径的大小顺序为W>Q>Y>Z | |
| B. | X、Y、W三种元素的非金属性大小顺序为X>Y>W | |
| C. | X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应 | |
| D. | 元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
1.一种新催化剂能在室温下催化空气氧化甲醛:HCHO+O2→CO2+H2O,该反应( )
| A. | 反应物和生成物均为分子晶体 | |
| B. | 反应物和生成物都为直线型分子 | |
| C. | 反应时旧键断裂放出能量,新键形成吸收能量 | |
| D. | 产物中CO2的键能大于H2O,所以沸点高于H2O |
11.下列离子方程式书写正确的是( )
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| D. | FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
18.下列各组物质均属于分子晶体且均为化合物的是( )
| A. | NH3、HD、C10H8 | B. | PCl3、CO2、AlCl3 | C. | SO2、SiO2、P2O5 | D. | CCl4、H2O2、Na2S |
15.下列有关强电解质叙述正确的是( )
| A. | 强电解质在熔化状态下一定能够导电 | |
| B. | 离子化合物一定是强电解质 | |
| C. | 具有强极性键的共价化合物是强电解质 | |
| D. | 强电解质水溶液一定具有很强的导电能力 |
16.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 1mol N2中含有的电子数为2NA | |
| B. | 标准状态下,22.4L水所含的氧原子数为NA | |
| C. | 23g钠在化学反应中失去电子数目为10 NA | |
| D. | 2g氢气所含的氢原子数为2NA |
