题目内容
3.某温度时 NaHCO3溶液pH=8,则三种含碳元素粒子由大到小的顺序为:②>③>①①CO32- ②HCO3- ③H2CO3.
分析 常温下,0.1mol•L-1NaHCO3溶液的pH等于8,说明溶液中HCO3-水解程度大于电离程度,但其无论是水解程度还是电离程度都较小,据此分析.
解答 解:常温下,0.1mol•L-1NaHCO3溶液的pH等于8,说明溶液中HCO3-水解程度大于电离程度:HCO3-+H2O?H2CO3+OH-,HCO3-?CO32-+H+,故c(H2CO3)>c(CO32-),但其无论是水解程度还是电离程度都较小,故c(HCO3-)>c(H2CO3)>c(CO32-),即②>③>①,故答案为:②>③>①.
点评 本题考查离子浓度大小比较为高频考点,明确溶质性质是解本题关键,侧重考查学生分析判断能力,题目难度不大.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
1.下列化学反应的离子方程式正确的是( )
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 用往氯化铁中加铁粉:Fe+Fe3+═2Fe2+ | |
| C. | 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O | |
| D. | 往碳酸镁中滴加稀盐酸:MgCO3+2H+═CO2↑+H2O+Mg2+ |
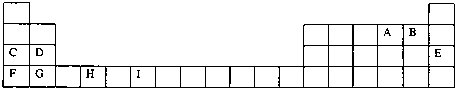
2.元素周期表前四周期的元素中,同一周期的两种主族元素原子的核外电子数差值不可能为( )
| A. | 6 | B. | 8 | C. | 11 | D. | 16 |
18.实现下列转化的反应方程式中,正确的是( )
| A | H2SO3→H2SO4: | 2H2SO3+O2=2H2SO4 |
| B | Fe→Fe3+: | 2Fe+6H+=2Fe3++3H2↑ |
| C | Br-→Br2: | 2Br-+I2=B r2+2I- |
| D | Cu→CuSO4: | Cu+2H2SO4(稀)=CuSO4+SO2↑+2H2O |
| A. | A | B. | B | C. | C | D. | D |
15.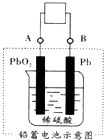 电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,
根据上述变化,下列说法中正确的是( )
 电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,
根据上述变化,下列说法中正确的是( )
| A. | 放电时电极 PbO2 发生氧化反应 | |
| B. | 放电时电子流向由B到A | |
| C. | 工作时蓄电池里电解质溶液的pH不变 | |
| D. | 充电时阴极反应是PbSO4-2e-+2H2O═PbO2+4H++SO42- |
12.下列物质为纯净物的是( )
| A. | 水泥 | B. | 水玻璃 | C. | 氨水 | D. | 液氯 |