题目内容
15. 电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,
根据上述变化,下列说法中正确的是( )
| A. | 放电时电极 PbO2 发生氧化反应 | |
| B. | 放电时电子流向由B到A | |
| C. | 工作时蓄电池里电解质溶液的pH不变 | |
| D. | 充电时阴极反应是PbSO4-2e-+2H2O═PbO2+4H++SO42- |
分析 A.放电时该装置是原电池,Pb作负极,发生氧化反应,PbO2作正极,发生还原反应;
B.放电时,电子从负极沿导线流向正极;
C.根据Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O知,放电时氢离子参加反应,充电时生成氢离子;
D.充电时阴极上得电子发生还原反应,与原电池负极反应式正好相反.
解答 解:A.放电时该装置是原电池,Pb作负极,发生氧化反应,PbO2作正极,正极上得电子而发生还原反应,故A错误;
B.放电时,电子从负极沿导线流向正极,放电时Pb是负极、PbO2是正极,电子从B沿导线流向A,故B正确;
C.根据Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O知,放电时氢离子参加反应,溶液的pH增大,充电时生成氢离子,溶液的pH减小,故C错误;
D.充电时阴极上得电子发生还原反应,与原电池负极反应式正好相反,阴极反应式为PbSO4+2e-═Pb+SO42-,故D错误;
故选B.
点评 本题考查原电池和电解池原理,为高频考点,明确各个电极上发生的反应、电子流向是解本题关键,知道正负极的判断方法,难点是电极反应式的书写,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
13.对于某些离子的检验及结论一定正确的是( )
| A. | 加入盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入KSCN溶液无明显现象,再滴加饱和氯水溶液出现血红色,一定有Fe2+ |
6.部分弱酸的电离平衡常数如表:下列选项错误的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2HCOOH+CO32-═2HCOO-+H2O+CO2↑ | |
| B. | 2CN-+H2O+CO2═2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | HCOO-和CN-结合H+能力前者小于后者 |
10.下列物质不属于天然高分子化合物的是( )
| A. | 淀粉 | B. | 纤维素 | C. | 蛋白质 | D. | 塑料 |
20.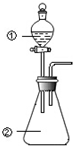 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )
 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀硫酸 | 硝酸亚铁溶液 | 无明显现象 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
5.某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)实验过程中,使用分液漏斗滴加液体的操作是打开分液漏斗上口的活塞(或将活塞上的凹槽与瓶口上的小孔对齐),旋开分液漏斗的旋塞,缓慢滴加.
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”).原因为NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准
(3)实验Ⅲ烧瓶中产生的SO2气体通入溴水溶液中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.
(4)实验Ⅱ中量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理.如图2,以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.
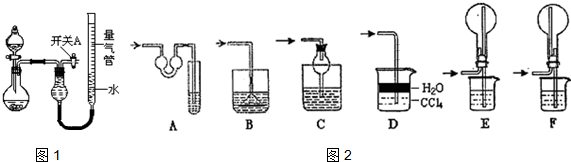
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积已换算成标准状况,忽略滴入液体体积对气体体积的影响)
根据上述数据,可计算出镁铝合金中铝的质量分数为27.0%.(H:1 Mg:24 Al:27)
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | Na2SO3固体、浓H2SO4 | SO2 | |
| Ⅳ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”).原因为NO会与装置中空气反应,生成NO2溶于水,使测得的NO气体体积不准
(3)实验Ⅲ烧瓶中产生的SO2气体通入溴水溶液中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.
(4)实验Ⅱ中量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理.如图2,以下各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.

(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
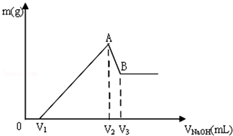 将Mg、Al组成的混合物共0.1mol溶于100mL 3mol/LHCl溶液中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V的变化如图所示:
将Mg、Al组成的混合物共0.1mol溶于100mL 3mol/LHCl溶液中,再滴加1mol/LNaOH 溶液,在滴加NaOH溶液的过程中,沉淀的质量m随NaOH溶液体积V的变化如图所示: