题目内容
8.在100mL的混合溶液中,硝酸和硫酸的物质的量的浓度分别是0.4mol/L和0.1mol/L,向该混合液中加入1.92g的铜,加热使其充分反应.试计算:(1)理论上生成的一氧化氮(标准状况下)的体积是多少升?
(2)若反应后溶液的体积不发生变化,溶液中Cu2+物质的量浓度是多少?
分析 1.92g的铜的物质的量n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,混合酸中n(H+)=0.4mol/L×0.1L+0.1mol/L×2×0.1L=0.06mol,n(NO3-)=0.4mol/L×0.1L=0.04mol,
发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,判断过量后以不足量代入计算.
解答 解:1.92g的铜的物质的量n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,混合酸中n(H+)=0.4mol/L×0.1L+0.1mol/L×2×0.1L=0.06mol,n(NO3-)=0.4mol/L×0.1L=0.04mol,
由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,Cu与NO3-过量,H+不足,氢离子的物质的量进行计算,
设一氧化氮的体积是V L,产生的铜离子的物质的量为x moL,
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
8 3 44.8
0.06 x V
$\frac{8}{0.06}=\frac{3}{x}=\frac{44.8}{V}$
V=0.336,x=0.0225mol,
c(Cu2+)=$\frac{0.0225mol}{0.1L}$=0.225mol/L,
答:(1)理论上生成的一氧化氮(标准状况下)的体积是0.336L;
(2)若反应后溶液的体积不发生变化,溶液中Cu2+物质的量浓度是0.225mol/L.
点评 本题考查离子反应的计算,解答该题的关键是把握反应的离子方程式及判断反应的过量问题,侧重分析能力和计算能力的考查,题目难度中等.

练习册系列答案
相关题目
6.固体AgCl在水中、在0.01mol/LNaCl溶液中和在0.05mol/LAgNO3溶液中的溶解度分别为S1、S2、S3,则有( )
| A. | S1>S2>S3 | B. | S2>S1>S3 | C. | S3>S2>S1 | D. | S2>S3>S1 |
16.某元素M的逐级电离能(kJ•mol-1)分别为580,1820,2750,11600.该元素氧化物的化学式最可能是( )
| A. | MO | B. | MO2 | C. | MO3 | D. | M2O3 |
13.下列叙述中正确的是( )
| A. | 稀醋酸与稀氢氧化钠溶液发生中和反应的热化学方程式为:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol | |
| B. | 在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热 | |
| C. | 未来氢气作为新能源的其中一个优点是充分燃烧的产物不污染环境 | |
| D. | 加入催化剂,可以改变化学反应的反应热 |
20.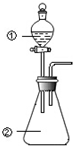 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )
 用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )
用图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是 ( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀硫酸 | 硝酸亚铁溶液 | 无明显现象 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 立即产生大量白色沉淀 |
| D | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
17.下列叙述正确的是( )
| A. | 二氧化硅是酸性氧化物,不与任何酸反应 | |
| B. | 因为CO2通入水玻璃中可制得硅酸,说明碳酸的酸性比硅酸酸性强 | |
| C. | SiO2是制造光导纤维的材料,SiO2晶体中,每个硅原子与两个氧原子相连 | |
| D. | 工业上制玻璃的主要原料有:黏土、石灰石、石英 |