题目内容
8.按题目要求答题:(1)(CH3)2CHCH(CH3)CH2CH3的系统命名是2,3-二甲基戊烷
(2)写出苯与液溴发生取代反应的化学方程式:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr
(3)某烃A的相对分子质量为84,能与氢气发生加成反应.A的一氯取代产物只有一种,则A的结构简式为
 .
.
分析 (1)烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,写出支链名称和位置,由简到繁同基合并,最后写主链名称,据此分析;
(2)苯与溴发生取代反应生成溴苯和HCl;
(3)分子中含有一个碳碳双键,为烯烃,设分子式为CnH2n,结合M=84可计算分子式,结合分子中只有一种类型的氢原子,则结构对称来推断结构简式;
解答 解:(1)烷烃命名时,要选最长的碳链为主链,故主链上有5个碳原子,故为戊烷,从离支链近的一端给主链上碳原子编号,故在2号和3号碳原子上各有一个甲基,故名称为2,3-二甲基戊烷,
故答案为:2,3-二甲基戊烷;
(2)苯与溴发生取代反应生成溴苯和HCl,该反应为C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr,
故答案为:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr;
(3)含有1个碳碳双键,则A应为烯烃,设分子式为CnH2n,相对分子质量为84,则有14n=84,n=6,A的一氯取代产物只有一种说明分子中只有一种类型的氢,说明结构对称,即双键C上的4个H均被甲基取代,其结构简式应为 ,
,
故答案为: .
.
点评 本题考查了常见有机物的命名、化学方程式的书写、同系物与同分异构体的判断,题目难度中等,试题涉及的题量过大,知识点较多,充分考查了学生对书写知识的掌握情况.

练习册系列答案
相关题目
8.青蒿酸(简式如图所示)可用作合成青蒿素的原料,下列关于青蒿酸的说法中正确的是( )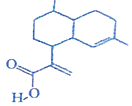

| A. | 该物质属于芳香族化合物 | B. | 该物质易溶于水 | ||
| C. | 能发生取代反应和加成反应 | D. | 分子中所有碳原子可能共平面 |
19. 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
(1)已知每破坏1mol有关化学键需要的能量如表:
则△H=-91.3KJ/mol.
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将不变(填“增大”“减小”或“不变”)
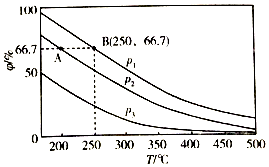
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示.
①其中,p1、p2和p3由大到小的顺序是p1>p2>p3,其原因是温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大.
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)< vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=5925.9L2/mol2(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①②③(填序号).
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.(1)已知每破坏1mol有关化学键需要的能量如表:
| H-H | N-H | N-N | N |
| 435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将不变(填“增大”“减小”或“不变”)
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示.
①其中,p1、p2和p3由大到小的顺序是p1>p2>p3,其原因是温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大.
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)< vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=5925.9L2/mol2(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①②③(填序号).
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
16. 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.
(1)表中五种元素金属性最强的元素为Na(填元素符号),c、e两元素形成的离子化合物c2e的电子式为 .
.
(2)c、d、e三种元素的简单离子中,半径最小的是Al3+(用元素符号表示).
(3)b、e两元素分别与a形成的最简单气态化合物的稳定性的关系为H2O>H2S(或H2S<H2O)(用化学式表示).
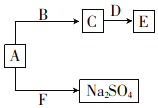
(4)已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成.它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
①写出物质E的化学式:NaAlO2.
②写出A与F反应的化学方程式:Na2O2+SO2=Na2SO4.
 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.| a | |||||
| b | |||||
| c | d | e |
 .
.(2)c、d、e三种元素的简单离子中,半径最小的是Al3+(用元素符号表示).
(3)b、e两元素分别与a形成的最简单气态化合物的稳定性的关系为H2O>H2S(或H2S<H2O)(用化学式表示).
(4)已知A、B、C、D、E、F六种化合物均由上述元素中的几种组成.它们之间的关系如图所示,A为淡黄色固体,B是常见液体,D是两性氧化物,F是引起酸雨的主要气体.
①写出物质E的化学式:NaAlO2.
②写出A与F反应的化学方程式:Na2O2+SO2=Na2SO4.
13.己知aX+和bY-具有与氖原子相同的电子层结构,下列关系正确的是( )
| A. | 质子数:a>b | B. | 离子半径:r(aX+)>r(bY-) | ||
| C. | X、Y可形成XY2型化合物 | D. | 原子半径:r(Y)>r(X) |
20.为了高效解决化石燃料燃烧存在的问题,不需要研究的问题有( )
| A. | 杜绝化石燃料的使用,从源头上解决问题 | |
| B. | 减少燃料燃烧产生的热量损耗的技术,提高燃料利用率的措施 | |
| C. | 防止燃料燃烧造成环境污染的方法 | |
| D. | 通过化学方法把化石燃料转化成洁净燃料 |
18.已知X+Y═M+N反应中的能量变化过程如图,则下列有关说法正确的是( )
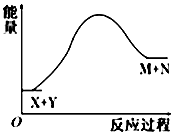

| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X和Y的总能量一定低于M和N的总能量 |