题目内容
19. 氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.
氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)?2NH3(g)△H.(1)已知每破坏1mol有关化学键需要的能量如表:
| H-H | N-H | N-N | N |
| 435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(2)在恒温、恒压容器中,氨体积比1:3加入N2和H2进行合成氨反应,达到平衡后,再向容器中充入适量氨气,达到新平衡时,c(H2)将不变(填“增大”“减小”或“不变”)
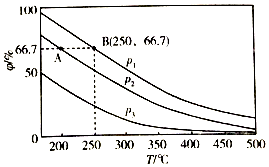
(3)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(φ)如图所示.
①其中,p1、p2和p3由大到小的顺序是p1>p2>p3,其原因是温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大.
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)< vB(N2)(填“>”“<”或“=”)
③若在250℃、p1条件下,反应达到平衡时容器的体积为1L,则该条件下合成氨的平衡常数K=5925.9L2/mol2(保留一位小数).
(4)H2NCOONH4是工业由氨气合成尿素的中间产物.在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)?2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①②③(填序号).
①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变.
分析 (1)依据△H=反应物键能和-生成物键能和求算;
(2)保持恒温恒压,将体积比1:3加入N2和H2充入一密闭容器中与起始时在该容器中充入适量氨气,为等效平衡状态;
(3)①由方程式N2+3H2?2NH3可知,增大压强,平衡正向移动,氨的体积分数越大;
②温度越大,压强越大,反应速率越大;
③化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
(4)H2NCOONH4(s)?2NH3(g)+CO2(g),反应物为固体,生成物为气体,化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:(1)N2 (g)+3H2 (g)?2NH3(g)△H=反应物键能和-生成物键能和=945.8KJ/mol+3×435.9KJ/mol-6×390.8KJ/mol=-91.3KJ/mol,
故答案为:-91.3KJ/mol;
(2)保持恒温恒压,达到平衡后,再向容器中充入适量氨气,在恒压条件下与原平衡状态相同,为等效平衡,平衡时两种情况平衡状态相同,各物质的含量不变,所以达到新平衡时,c(H2)将不变,
故答案为:不变;
(3)①由N2+3H2?2NH3可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为P1>P2>P3,因此压强关系是P1>P2>P3,
故答案为:p1>p2>p3;温度相同时,加压平衡正向移动,故压强越大平衡混合物中氨的体积分数越大;
②温度越大,压强越大,反应速率越大,p1>p2,由图可知,B对应的温度、压强大,则反应速率大,
故答案为:<;
③N2+3H2?2NH3
开始 0.1 0.3 0
转化 x 3x 2x
平衡 0.1-x 0.3-3x 2x $\frac{2x}{0.1-x+0.3-3x+2x}$=0.667,x=0.08
K=$\frac{{C}^{2}(N{H}_{3})}{C({N}_{2})×{C}^{3}({H}_{2})}$=$\frac{0.16×0.16}{0.02×(0.06)^{3}}$=5925.9L2/mol2,
故答案为:5925.9L2/mol2;
(4)H2NCOONH4(s)?2NH3(g)+CO2(g),
①该反应为气体体积增大的反应,反应过程中压强逐渐增大,当压强不变时,表明正逆反应速率相等,该反应达到平衡状态,故①正确;
②由于H2NCOONH4是固体,没有达到平衡状态前,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故②正确;
③由于H2NCOONH4是固体,生成物全部为气体,气体的物质的量在增加,当混合气体的总物质的量不变,说明正逆反应速率相等,达到了平衡状态,故③正确;
④混合气体的平均相对分子质量=$\frac{混合气体的质量总和}{混合气体的物质的量总和}$,混合气体的质量恒等于H2NCOONH4(s)分解的质量,气体的物质的量为分解的H2NCOONH4(s)的三倍,混合气体的平均相对分子质量不变恒不变,不能说明反应达到平衡状态,故④错误;
⑤因反应物(NH2COONH4)是固体物质,所以密闭容器中NH3的体积分数始终不变,故⑤错误;
故答案为:①②③.
点评 本题考查化学平衡的影响因素、化学平衡的标志、平衡常数计算等问题,题目难度中等.侧重考查学生分析和解决问题的能力,(4)达到平衡状态的标志判断为易错点.

| 实验 | 现象 | 结论 | |
| A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
| B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
| C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  | B. |  | C. |  | D. |  |
| A. | 30 | B. | 36 | C. | 39 | D. | 42 |
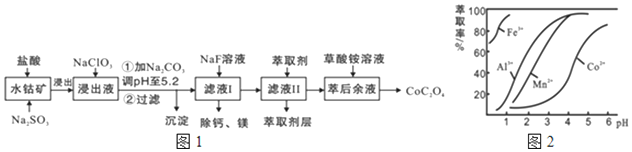
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的PH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将Fe2+氧化为Fe3+; 调PH至5.2,沉淀的主要成分为Al(OH)3、Fe(OH)3
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去Mn2+;使用萃取剂适宜的pH是B
A.接近2.0 B.接近3.0 C.接近5.0
(4)除钙、镁是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀,已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+):c(Ca2+)=0.7.
(5)已知含钴废料中含Co2O3质量分数为a%,若取mkg该含钴废料按照上述流程,理论上最多能制得草酸钴晶体的质量为$\frac{1830ma}{83}$或16.6mag.

 .
.