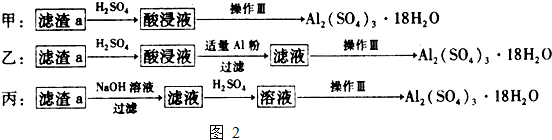
题目内容
 原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:
原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:(1)B在周期表中的位置是
(2)根据等电子原理分析,BC2+中B原子的轨道杂化类型是
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、
I5…,推测D元素的电离能突增应出现在第
(4)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为
(5)E的基态原子有
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:原子序数依次递增的A、B、C、D、E是周期表中前30号元素,已知A的最外层电子数是其内层电子数的2倍,A原子只能有2个电子层,最外层电子数为4,则A为C元素;
A与C形成的常见化合物之一是主要的温室气体,则C为O元素;结合原子序数可知B为N元素;
D与A同主族,其单质在同周期元素所形成的单质中熔点最高,该单质为Si,则D为Si;
E原子M能层为全充满状态,且核外的未成对电子只有一个,其原子核外电子排布为1s22s22p63s23p63d104s1,则E为Cu;
综上所述:A为C元素、B为N元素、C为O元素、D为Si元素、E为Cu元素,据此进行解答.
A与C形成的常见化合物之一是主要的温室气体,则C为O元素;结合原子序数可知B为N元素;
D与A同主族,其单质在同周期元素所形成的单质中熔点最高,该单质为Si,则D为Si;
E原子M能层为全充满状态,且核外的未成对电子只有一个,其原子核外电子排布为1s22s22p63s23p63d104s1,则E为Cu;
综上所述:A为C元素、B为N元素、C为O元素、D为Si元素、E为Cu元素,据此进行解答.
解答:
解:原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍,A原子只能有2个电子层,最外层电子数为4,则A为碳元素;A与C形成的常见化合物之一是主要的温室气体,则C为O元素;结合原子序数可知B为N元素;D与A同主族,其单质在同周期元素所形成的单质中熔点最高,则D为Si;E原子M能层为全充满状态,且核外的未成对电子只有一个,其原子核外电子排布为1s22s22p63s23p63d104s1,则E为Cu,
(1)B为N元素,在周期表中的位置是:第二周期第ⅤA族,该主族元素的气态氢化物中,沸点最低的是PH3,
故答案为:第二周期第ⅤA族;PH3;
(2)B为N元素、C为O元素,NO2+与CO2为等电子体,根据等电子原理可知,N原子与C原子的杂化发生相同,CO2分子为直线型结构,C原子采取sp杂化,故NO2+中N原子为sp杂化,
故答案为:sp;
(3)D为Si元素,Si元素原子1s22s22p63s23p2,第三能层4个电子能量相差不是很大,与第二能层的电子能量相差较大,故其电离能突增应出现在第五电离能,
故答案为:五;
(4)A为C元素,C元素的一种相对分子质量为28的氢化物为C2H4,结构简式为CH2=CH2,其分子中含有4个C-H键、1个C=C双键,单键为σ键,双键含有1个σ键与1个π键,故其分子中σ键与π键的个数之比为:5:1,
故答案为:5:1;
(5)E为Cu,Cu的基态原子核外电子排布为:1s22s22p63s23p63d104s1,所以铜原子有s、p、d共3种形状不同的原子轨道;
Cu2+的电子排布式为:1s22s22p63s23p63d9,所以铜离子的价电子排布式为:3d9,
故答案为:3;3d9.
(1)B为N元素,在周期表中的位置是:第二周期第ⅤA族,该主族元素的气态氢化物中,沸点最低的是PH3,
故答案为:第二周期第ⅤA族;PH3;
(2)B为N元素、C为O元素,NO2+与CO2为等电子体,根据等电子原理可知,N原子与C原子的杂化发生相同,CO2分子为直线型结构,C原子采取sp杂化,故NO2+中N原子为sp杂化,
故答案为:sp;
(3)D为Si元素,Si元素原子1s22s22p63s23p2,第三能层4个电子能量相差不是很大,与第二能层的电子能量相差较大,故其电离能突增应出现在第五电离能,
故答案为:五;
(4)A为C元素,C元素的一种相对分子质量为28的氢化物为C2H4,结构简式为CH2=CH2,其分子中含有4个C-H键、1个C=C双键,单键为σ键,双键含有1个σ键与1个π键,故其分子中σ键与π键的个数之比为:5:1,
故答案为:5:1;
(5)E为Cu,Cu的基态原子核外电子排布为:1s22s22p63s23p63d104s1,所以铜原子有s、p、d共3种形状不同的原子轨道;
Cu2+的电子排布式为:1s22s22p63s23p63d9,所以铜离子的价电子排布式为:3d9,
故答案为:3;3d9.
点评:本题考查了位置、结构与性质的关系,题目难度中等,正确推断各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,试题侧重基础知识的考查,有利于培养学生的分析、理解能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某状况下,2gCO2 气体的体积是1120ml,2gA气体的体积是770ml,则A的相对分子质量为( )
| A、48 | B、64 | C、72 | D、56 |
把0.02mol/L CH3COOH溶液和0.01mol/L NaOH溶液等体积混合,则混合溶液中微粒浓度关系,正确的是( )
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COOH)>c(CH3COO-) |
| C、2c(H+)=c(CH3COO-)-c(CH3COOH) |
| D、c(CH3COOH)+c(CH3COO-)=0.01mol/L |
天然色素的提取往往应用到萃取操作,现在有用大量水提取的天然色素,下列溶剂不能用来萃取富集这些天然色素的是( )
| A、石油醚 | B、丙酮 | C、乙醇 | D、乙醚 |