题目内容
将甲苯加入到KMnO4和Na2CO3混合溶液中加热反应,反应后加入足量的盐酸,析晶、过滤、洗涤,再提纯后,得到纯的A晶体.称取0.1221g A,加入50.00mL、0.04000mol?L-1 NaOH溶液溶解,再加入20.00mL、0.05000 mol?L-1 HCl溶液,恰好为化学计量点,加水稀释到150.0 mL,称此液为x液.另称取0.1221g A,加水100.0mL和12.50mL、0.04000mol?L-1 NaOH溶液,搅匀后,测得此溶液的pH值为4.19.
(1)计算A的摩尔质量;
(2)计算X溶液的pH(活度系数为1);
(3)在制备A时,加入盐酸有什么作用?
(1)计算A的摩尔质量;
(2)计算X溶液的pH(活度系数为1);
(3)在制备A时,加入盐酸有什么作用?
考点:化学方程式的有关计算
专题:计算题
分析:(1)0.1221g A,加入50.00mL、0.04000mol?L-1 NaOH溶液溶解,再加入20.00mL、0.05000 mol?L-1 HCl溶液,恰好为化学计量点,根据氢氧化钠的物质的量求出A的物质的量,再根据M=
计算;
(2)求出x液中NaA的浓度,Kh=
=
,称取0.1221g A,加水100.0mL和12.50mL、0.04000mol?L-1 NaOH溶液,搅匀后,测得此溶液的pH值为4.19,据此求出Ka,则可以求出c(OH-),再根据Kw计算氢离子浓度和pH;
(3)将甲苯加入到KMnO4和Na2CO3混合溶液中加热反应生成苯甲酸钠,加盐酸,会生成苯甲酸,同时HCl可以酸性环境、还原过量的高锰酸钾.
| m |
| n |
(2)求出x液中NaA的浓度,Kh=
| c(A)c(OH-) |
| c(A-) |
| Kw |
| Ka |
(3)将甲苯加入到KMnO4和Na2CO3混合溶液中加热反应生成苯甲酸钠,加盐酸,会生成苯甲酸,同时HCl可以酸性环境、还原过量的高锰酸钾.
解答:
解:(1)0.1221g A,加入50.00mL、0.04000mol?L-1 NaOH溶液溶解,再加入20.00mL、0.05000 mol?L-1 HCl溶液,恰好为化学计量点,则与A反应的氢氧化钠为0.04000mol?L-1×0.05000L-0.05000 mol?L-1×0.02000L=0.001mol,则A的物质的量为0.001mol,所以M=
=
=122.1g/mol;
答:A的摩尔质量为122.1g/mol;
(2)x液中NaA的浓度为
=0.00667mol/L,则c(A-)=0.00667mol/L,
另称取0.1221g A,加水100.0mL和12.50mL、0.04000mol?L-1 NaOH溶液,搅匀后,测得此溶液的pH值为4.19,
则剩余的A的物质的量=0.001mol-0.01250mL×0.04000mol?L-1=0.0005mol,
说明加入的NaOH的量恰好是A的一半,即中和了50%,则c(A-)=c(A),则Ka=
=c(H+),所以pH=pKa=4.19;
在x溶液中Kh=
=
,则c(A)×c(OH-)=
×c(A-),即c(OH-)=
=
=10-5.99mol/L,
所以pH=14-5.99=8.01;
答:X溶液的pH为8.01;
(3)将甲苯加入到KMnO4和Na2CO3混合溶液中加热反应生成苯甲酸钠,加盐酸,苯甲酸钠会生成苯甲酸晶体析出,同时HCl可以酸性环境、HCl具有还原性能还原生成的二氧化锰和过量的高锰酸钾;
答:在制备A时,加入盐酸的作用为:一是提供酸性,二是还原MnO2及过量的KMnO4成Mn2+,三是强制NaA成HA析出.
| m |
| n |
| 0.1221g |
| 0.001mol |
答:A的摩尔质量为122.1g/mol;
(2)x液中NaA的浓度为
| ||
| 0.15L |
另称取0.1221g A,加水100.0mL和12.50mL、0.04000mol?L-1 NaOH溶液,搅匀后,测得此溶液的pH值为4.19,
则剩余的A的物质的量=0.001mol-0.01250mL×0.04000mol?L-1=0.0005mol,
说明加入的NaOH的量恰好是A的一半,即中和了50%,则c(A-)=c(A),则Ka=
| c(H+)?c(A-) |
| c(A) |
在x溶液中Kh=
| c(A)c(OH-) |
| c(A-) |
| Kw |
| Ka |
| Kw |
| Ka |
|
|
所以pH=14-5.99=8.01;
答:X溶液的pH为8.01;
(3)将甲苯加入到KMnO4和Na2CO3混合溶液中加热反应生成苯甲酸钠,加盐酸,苯甲酸钠会生成苯甲酸晶体析出,同时HCl可以酸性环境、HCl具有还原性能还原生成的二氧化锰和过量的高锰酸钾;
答:在制备A时,加入盐酸的作用为:一是提供酸性,二是还原MnO2及过量的KMnO4成Mn2+,三是强制NaA成HA析出.
点评:本题以苯甲酸的制取为知识背景,考查了物质的量的计算、电离常数的计算、水解常数的计算以及pH的计算,侧重于考查学生的分析能力和计算能力,题目难度较大.

练习册系列答案
相关题目
X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲.X、Y、Z 3种元素形成化合物乙.下列说法不正确的是( )
| A、原子半径:W>Y>Z>M>X |
| B、化合物乙中一定只有共价键 |
| C、W元素是一种亲氧元素 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM |
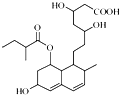 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )| A、能与FeCl3溶液发生显色反应 |
| B、能使酸性KMnO4溶液褪色 |
| C、1mol该物质与足量钠发生反应生成4molH2 |
| D、1mol该物质最多可与1molNaOH反应 |

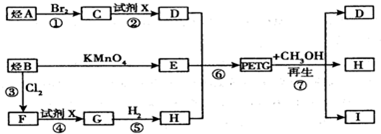 这种材料可采用如图所示的合成路线已知:(1)
这种材料可采用如图所示的合成路线已知:(1)
 A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的 原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:
原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题: