��Ŀ����
NaHCO3����Ҫ�Ļ���ԭ�ϣ���ʵ�������ͨ��������������õ���
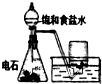
����ʳ��ˮ
����Һ
��ɫ����
��֪һЩ������20�桢30��ʱ�ܽ�����ݣ�
��ش�
��1�������Ӧ�Ļ�ѧ����ʽ�� ��
��2������NH3��CO2��������ͨ��˳����û�г�����ԭ���� ��
��3����������ð�ɫ������һ����NaHCO3��ԭ���� ��
��4�����������NaHCO3�����ӷ���ʽ�� ��
��5���������������ܽ��Լ������ܽ�����ݣ����������������ڽϵ��¶��½���ʱЧ�����õ�ԭ�� ��
����ʳ��ˮ
| ����NH3 |
| �� |
| ����CO2 |
| �� |
��֪һЩ������20�桢30��ʱ�ܽ�����ݣ�
�ܽ�ȣ�g�� �¶ȣ��棩 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl | Na2CO3 | ��NH4��2CO3 |
| 20 | 28.7 | 21.7 | 9.6 | 31.5 | 21.5 | 100 |
| 30 | 41.1 | 27.0 | 11.1 | 36.3 | 39.7 | ��100 |
��1�������Ӧ�Ļ�ѧ����ʽ��
��2������NH3��CO2��������ͨ��˳����û�г�����ԭ����
��3����������ð�ɫ������һ����NaHCO3��ԭ����
��4�����������NaHCO3�����ӷ���ʽ��
��5���������������ܽ��Լ������ܽ�����ݣ����������������ڽϵ��¶��½���ʱЧ�����õ�ԭ��
���㣺���ҵ�������Ƽ��
ר�⣺
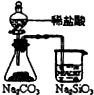
��������1��������ˮ���ܽ�Ƚϴ�����һˮ�ϰ����ݴ˽�ɣ�
��2��������������ˮ��������̼���ܽ�Ȳ��ݴ˽�ɣ�
��3����������IJ�ͬ�¶��¸������ʵ��ܽ�Ȼش�
��4�����ݷ�Ӧԭ����д���ӷ�Ӧ����ʽ��
��5�����������ܽ������¶ȵĹ�ϵ�Լ����������ܽ�����¶ȱ仯�Ĺ�ϵ�������ɣ�
��2��������������ˮ��������̼���ܽ�Ȳ��ݴ˽�ɣ�
��3����������IJ�ͬ�¶��¸������ʵ��ܽ�Ȼش�
��4�����ݷ�Ӧԭ����д���ӷ�Ӧ����ʽ��
��5�����������ܽ������¶ȵĹ�ϵ�Լ����������ܽ�����¶ȱ仯�Ĺ�ϵ�������ɣ�
���
�⣺��1��������ˮ��Ӧ����һˮ�ϰ�������һˮ�ϰ������ֽ⣬�ʴ˷�Ӧ���棬��ѧ��Ӧ����ʽΪ��NH3+H2O?NH3?H2O���ʴ�Ϊ��NH3+H2O?NH3?H2O��
��2��NH3��������ˮ�������ͨ���������CO2��Ӧ����������HCO3-���Ӷ��õ�NaHCO3��������֮����CO2�ܽ��С��������NH3��ַ�Ӧ�����ܵõ�������HCO3-�����������ʴ�Ϊ��NH3��������ˮ�������ͨ���������CO2��Ӧ����������HCO3-���Ӷ��õ�NaHCO3��������֮����CO2�ܽ��С��������NH3��ַ�Ӧ�����ܵõ�������HCO3-����������
��3���Ƚ�һЩ������20�桢30��ʱ�ܽ�����ݿ�֪������ͬ�����£�NaHCO3���ܽ����С���ʴ�Ϊ������ͬ�����£�NaHCO3���ܽ����С��
��4�������Ķ�����̼ͨ�뵽��ˮ���Ȼ��ƵĻ����Һ�з�Ӧ����̼�����Ƴ������Ȼ�泥����ӷ�Ӧ����ʽΪ��Na++NH3?H2O+CO2=NaHCO3��+NH4+���ʴ�Ϊ��Na++NH3?H2O+CO2=NaHCO3��+NH4+��
��5����ΪNH3��H2O�е��ܽ�����¶ȵĽ��Ͷ������ڽϵ��¶��������ڰ������ܽ⣬NaHCO3���ܽ�����¶ȵĽ��Ͷ���С�����ڽϵ��¶����������������ʴ�Ϊ����ΪNH3��H2O�е��ܽ�����¶ȵĽ��Ͷ�����NaHCO3���ܽ�����¶ȵĽ��Ͷ���С��
��2��NH3��������ˮ�������ͨ���������CO2��Ӧ����������HCO3-���Ӷ��õ�NaHCO3��������֮����CO2�ܽ��С��������NH3��ַ�Ӧ�����ܵõ�������HCO3-�����������ʴ�Ϊ��NH3��������ˮ�������ͨ���������CO2��Ӧ����������HCO3-���Ӷ��õ�NaHCO3��������֮����CO2�ܽ��С��������NH3��ַ�Ӧ�����ܵõ�������HCO3-����������
��3���Ƚ�һЩ������20�桢30��ʱ�ܽ�����ݿ�֪������ͬ�����£�NaHCO3���ܽ����С���ʴ�Ϊ������ͬ�����£�NaHCO3���ܽ����С��
��4�������Ķ�����̼ͨ�뵽��ˮ���Ȼ��ƵĻ����Һ�з�Ӧ����̼�����Ƴ������Ȼ�泥����ӷ�Ӧ����ʽΪ��Na++NH3?H2O+CO2=NaHCO3��+NH4+���ʴ�Ϊ��Na++NH3?H2O+CO2=NaHCO3��+NH4+��
��5����ΪNH3��H2O�е��ܽ�����¶ȵĽ��Ͷ������ڽϵ��¶��������ڰ������ܽ⣬NaHCO3���ܽ�����¶ȵĽ��Ͷ���С�����ڽϵ��¶����������������ʴ�Ϊ����ΪNH3��H2O�е��ܽ�����¶ȵĽ��Ͷ�����NaHCO3���ܽ�����¶ȵĽ��Ͷ���С��
������������̼�����Ƶ��Ʊ�Ϊ���壬�ۺϿ������ʵ��Ʊ�����ѧ��Ӧԭ����������ѧ���ķ���������ʵ�������Ŀ��飬Ϊ��Ƶ���㣬�Ѷ��еȣ�

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
�������ӷ���ʽ����д��ȷ���ǣ�������
| A��ϡ�������ͭƬ�ϣ�Cu+2H+=Cu2++H2�� |
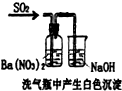
| B������������Һ��ϡ�����ϣ�Ba2++SO42-+OH-+H+=BaSO4��+H2O |
| C������ʯ��ˮ��ͨ������������̼��Ca2++2OH-+CO2=CaCO3��+H2O |
| D��ϡ������ڴ���ʯ�ϣ�CaCO3+2H+=Ca2++H2CO3 |
���л����ﲻ����������ǣ�������
| A��C2H4O2 |
| B��C4H10 |
| C��C2H4 |
| D��C20H40 |
 A��B��C��D��E��FΪ���ֶ�����Ԫ�أ����Ǻ˵�������ε�������֪��Bԭ�Ӻ��������������Ǵ���������������������������Eԭ��������
A��B��C��D��E��FΪ���ֶ�����Ԫ�أ����Ǻ˵�������ε�������֪��Bԭ�Ӻ��������������Ǵ���������������������������Eԭ��������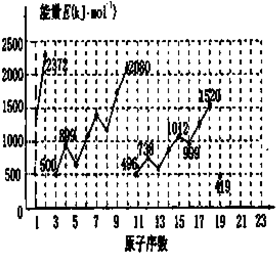 ԭ���������ε�����A��B��C��D��E�����ڱ���ǰ30��Ԫ�أ���֪A�����������������ڲ��������2����A��C�γɵij���������֮һ����Ҫ���������壻D��Aͬ���壬�䵥����ͬ����Ԫ�����γɵĵ������۵���ߣ�Eԭ��M�ܲ�Ϊȫ����״̬���Һ����δ�ɶԵ���ֻ��һ������ش��������⣺
ԭ���������ε�����A��B��C��D��E�����ڱ���ǰ30��Ԫ�أ���֪A�����������������ڲ��������2����A��C�γɵij���������֮һ����Ҫ���������壻D��Aͬ���壬�䵥����ͬ����Ԫ�����γɵĵ������۵���ߣ�Eԭ��M�ܲ�Ϊȫ����״̬���Һ����δ�ɶԵ���ֻ��һ������ش��������⣺