题目内容
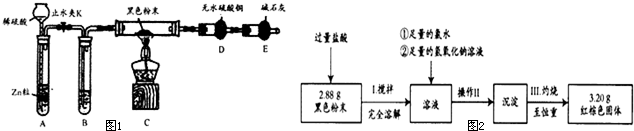
如图1是某化学兴趣小组设计的利用电子垃圾(含70% Cu、25% Al、4% Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:

已知下列信息:
Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式: .
(2)在操作Ⅱ中,x的取值范围是 .
(3)在操作Ⅲ中,蒸发浓缩需要的玻璃仪器有 .
(4)由滤渣a制取Al2(SO4)3?l8H2O,探究小组设计了如图2三种方案: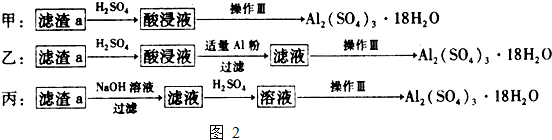
综合考虑上述三种方案,最具可行性的是 (填序号).
(5)为测定CuSO4?5H2O晶体的纯度,进行下列实验:取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol?L-1 EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-═CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL.(常温时,5%的Na2H2Y水溶液,其pH为4-6.)
①CuSO4?5H2O晶体的纯度是 .
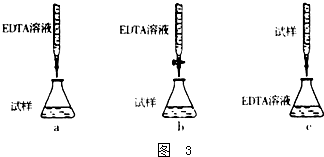
②如图3下列滴定方式中,最合理的是(夹持部分略去) (填序号).

已知下列信息:
Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式:
(2)在操作Ⅱ中,x的取值范围是
(3)在操作Ⅲ中,蒸发浓缩需要的玻璃仪器有
(4)由滤渣a制取Al2(SO4)3?l8H2O,探究小组设计了如图2三种方案:

综合考虑上述三种方案,最具可行性的是
(5)为测定CuSO4?5H2O晶体的纯度,进行下列实验:取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol?L-1 EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-═CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL.(常温时,5%的Na2H2Y水溶液,其pH为4-6.)
①CuSO4?5H2O晶体的纯度是
②如图3下列滴定方式中,最合理的是(夹持部分略去)

考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:由流程可知,金属混合物加入稀硫酸后铝、铁溶解,加入过氧化氢,亚铁离子被氧化为铁离子,铜在酸性溶液中被过氧化氢氧化为铜离子,过滤得到滤渣为Au、Pt,滤液中主要含有铁离子、铝离子和铜离子,加入氢氧化钠溶液调节溶液PH=5.2-5.4使铝离子全部沉淀,同时铁离子也转化为沉淀,过滤得到滤渣a为Al(OH)3和Fe(OH)3,用硫酸溶解后加Al调节pH,把铁离子转化为沉淀,过滤,滤液为硫酸铝溶液,蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2?18H2O晶体;含有硫酸铜的滤液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(1)酸性条件下铜被双氧水氧化成铜离子;
(2)调节pH使铁离子和铝离子完全沉淀,铜离子不沉淀,根据表中数据判断;
(3)蒸发浓缩需要的玻璃仪器有酒精灯、蒸发皿和玻璃棒;
(4)滤渣a是氢氧化铝和氢氧化铁,用硫酸溶解,调节pH除去铁离子;
(5)①根据反应方程式及滴定数据计算出硫酸铜的物质的量,再计算出硫酸铜晶体的质量分数;
②EDTA(Na2H2Y)标准溶液滴定其中的Cu2+,则EDTA盛放在酸式滴定管中.
(1)酸性条件下铜被双氧水氧化成铜离子;
(2)调节pH使铁离子和铝离子完全沉淀,铜离子不沉淀,根据表中数据判断;
(3)蒸发浓缩需要的玻璃仪器有酒精灯、蒸发皿和玻璃棒;
(4)滤渣a是氢氧化铝和氢氧化铁,用硫酸溶解,调节pH除去铁离子;
(5)①根据反应方程式及滴定数据计算出硫酸铜的物质的量,再计算出硫酸铜晶体的质量分数;
②EDTA(Na2H2Y)标准溶液滴定其中的Cu2+,则EDTA盛放在酸式滴定管中.
解答:
解:(1)酸性条件下铜被双氧水氧化成铜离子,则Cu与双氧水、硫酸反应生成硫酸铜和水,则反应的方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
(2)调节pH使铁离子和铝离子完全沉淀,铜离子不沉淀,根据表中数据可知pH=5.2是铝离子完全沉淀,pH=5.4时铜离子开始沉淀,所以调节pH为5.2≤x<5.4,
故答案为:5.2≤x<5.4;
(3)蒸发浓缩需要加热的仪器为酒精灯,在蒸发皿中进行,要用玻璃棒搅拌,所以用到的玻璃仪器有酒精灯、蒸发皿和玻璃棒,
故答案为:酒精灯、蒸发皿、玻璃棒;
(4)滤渣a是氢氧化铝和氢氧化铁,用硫酸溶解,得到硫酸铝和硫酸铁,加入Al调节pH使铁离子转化为氢氧化铁沉淀,过滤除去沉淀,则剩余的滤液为硫酸铝沉淀,然后蒸发浓缩得到硫酸铝晶体;所以乙方案符合;
故答案为:乙;
(5)①根据方程式可知20.00mL溶液中n(CuSO4?5H2O)=n(EDTA)=b×12×10-3mol;
所以m(CuSO4?5H2O)=b×12×10-3mol×250g/mol=3b g,
因此100mL溶液中CuSO4?5H2O的质量为:3b×5=15bg,所以ω=
×100%,
故答案为:
×100%;
②EDTA(Na2H2Y)标准溶液滴定其中的Cu2+,则EDTA盛放在滴定管中,该溶液显酸性,用酸式滴定管,所以最合理的为b;
故答案为:b.
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
(2)调节pH使铁离子和铝离子完全沉淀,铜离子不沉淀,根据表中数据可知pH=5.2是铝离子完全沉淀,pH=5.4时铜离子开始沉淀,所以调节pH为5.2≤x<5.4,
故答案为:5.2≤x<5.4;
(3)蒸发浓缩需要加热的仪器为酒精灯,在蒸发皿中进行,要用玻璃棒搅拌,所以用到的玻璃仪器有酒精灯、蒸发皿和玻璃棒,
故答案为:酒精灯、蒸发皿、玻璃棒;
(4)滤渣a是氢氧化铝和氢氧化铁,用硫酸溶解,得到硫酸铝和硫酸铁,加入Al调节pH使铁离子转化为氢氧化铁沉淀,过滤除去沉淀,则剩余的滤液为硫酸铝沉淀,然后蒸发浓缩得到硫酸铝晶体;所以乙方案符合;
故答案为:乙;
(5)①根据方程式可知20.00mL溶液中n(CuSO4?5H2O)=n(EDTA)=b×12×10-3mol;
所以m(CuSO4?5H2O)=b×12×10-3mol×250g/mol=3b g,
因此100mL溶液中CuSO4?5H2O的质量为:3b×5=15bg,所以ω=
| 15b |
| a |
故答案为:
| 15b |
| a |
②EDTA(Na2H2Y)标准溶液滴定其中的Cu2+,则EDTA盛放在滴定管中,该溶液显酸性,用酸式滴定管,所以最合理的为b;
故答案为:b.
点评:本题考查了物质的制备实验方案设计,题目涉及方程式的书写、除杂质、实验基本操作、物质含量的测定等,题目考查的知识点较多,侧重于基础知识的综合应用的考查,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列实验操作,能有效改变反应速率且达到变化要求的是( )
| A、为增大泡沫灭火器中Al2(SO4)3与小苏打的反应速率,改用小苏打和苏打的混合物 |
| B、为加快盐酸和锌制取氢气的速率又不减少氢气的量,可加少量硝酸银溶液 |
| C、在稀硫酸和铁粉反应制取氢气时,为减慢反应速率,可以加入适量醋酸钠 |
| D、用3 mL乙醇、2 mL浓H2SO4、2 mL冰醋酸制乙酸乙酯,为增大反应速率,可改用6 mL乙醇、4 mL浓H2SO4、4 mL冰醋酸 |
 凯氏定氮法测定奶粉中蛋白质含量的步骤如下:
凯氏定氮法测定奶粉中蛋白质含量的步骤如下:
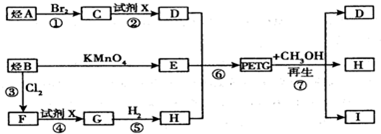 这种材料可采用如图所示的合成路线已知:(1)
这种材料可采用如图所示的合成路线已知:(1)
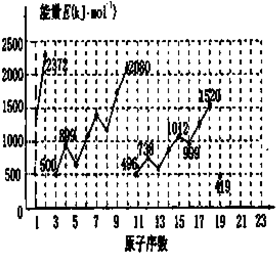 原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:
原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题: