题目内容
铝合金由于其优良的性能,已经成为人类生活中常用的金属材料.硬铝7075在航空工业中有着广泛的应用,含铝90.72%.一种由铝土矿(主要含氧化铝,还有二氧化硅、氧化铁和其他杂质)生产高纯度氧化铝的工艺流程如图.

实际生产中,由滤液Ⅱ到高纯度氧化铝(99.0%)的过程中会损失2%的铝,电解熔融的氧化铝制取金属铝的过程中会损失4%的铝,若要生产10吨硬铝7075,至少需要多少吨铝土矿(含氧化铝55.1%、二氧化硅6.0%)?(保留三位有效数字)

实际生产中,由滤液Ⅱ到高纯度氧化铝(99.0%)的过程中会损失2%的铝,电解熔融的氧化铝制取金属铝的过程中会损失4%的铝,若要生产10吨硬铝7075,至少需要多少吨铝土矿(含氧化铝55.1%、二氧化硅6.0%)?(保留三位有效数字)
考点:有关混合物反应的计算
专题:计算题
分析:根据10吨硬铝7075(含铝90.72%)中铝元素的质量=10t×90.72%=9.072t.生产过程中除去损失的铝,剩下的就是得到的铝的总量,共得到0.551x×99.0%×(1-2%)×(1-4%)t铝,二者是相同的量,即列出等式0.551x×99.0%×(1-2%)×(1-4%)=9.072t,从而求解答案.
解答:
解:假设生产10吨硬铝7075,至少需要x吨铝土矿,则铝土矿中Al2O3的质量为0.551x,实际生产中氧化铝的纯度为99.0%,还会损失2%的铝,电解熔融的氧化铝制取金属铝的过程中会损失4%的铝,所以x吨铝土矿共得到铝的质量为0.551x×99.0%×(1-2%)×(1-4%),又因为硬铝7075含铝90.72%,所以10吨硬铝7075含有的铝的质量为10t×90.72%=9.072t,即0.551x×99.0%×(1-2%)×(1-4%)=9.072t,解得x=36.4t.
答:若要生产10吨硬铝7075,至少需要36.4吨铝土矿.
答:若要生产10吨硬铝7075,至少需要36.4吨铝土矿.
点评:本题考查了学生的有关计算的解题思路问题,注意根据Al元素守恒进行计算,注意分析,理清思路,列出等式,进行计算,解答不会很难.

练习册系列答案
相关题目
下列物质中属于有机高分子化合物的是( )
| A、乙醇 | B、蛋白质 |
| C、阿斯匹林 | D、蔗糖 |
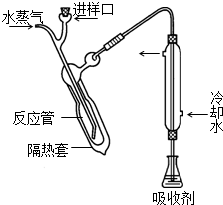 凯氏定氮法测定奶粉中蛋白质含量的步骤如下:
凯氏定氮法测定奶粉中蛋白质含量的步骤如下:
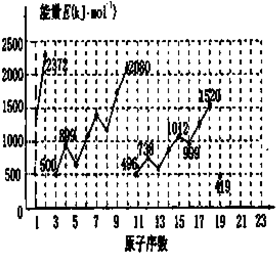 原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:
原子序数依次递增的A、B、C、D、E是周期表中前30号元素.已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题: