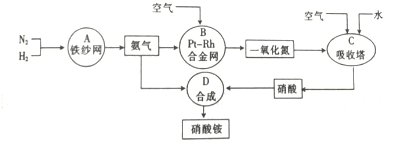
题目内容
9.用物理方法从植物体中提取,或是用化学方法合成药用化学物质,治疗病症,挽救性命,一直是科学家们致力研究的课题.请用化学知识分析“青蒿素”、“华法林”两种药物的结构及合成过程.Ⅰ.2015年诺贝尔医学奖授予中国女药学家屠呦呦.“因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”
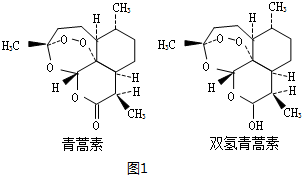
下列关于青蒿素和双氢青蒿素(结构如图1所示)的说法错误的是D.
A.青蒿素分子中含有过氧键、酯基和醚键
B.青蒿素的分子式为C15H22O5
C.由双氢青蒿素转化为青蒿素的反应属氧化反应
D.双氢青蒿素分子中有2个六元环和2个七元环
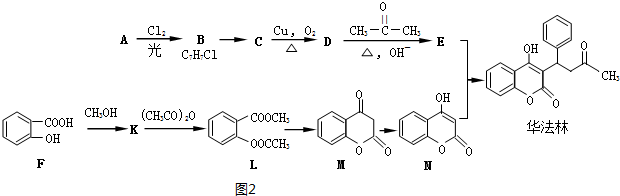
Ⅱ.华法林是一种治疗心脑血管疾病的药物,其合成路径如图2(部分反应条件略去).
已知:①
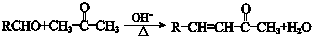
②
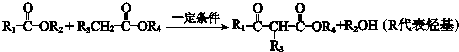
(1)A属于芳香烃,名称是甲苯;
(2)C生成D的反应类型是氧化反应; E与N合成华法林的反应类型是加成反应.
(3)B→C的转化过程中的化学反应方程式为
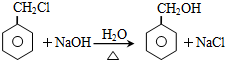 ;
;(4)E的结构简式是
 .L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为
.L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 .
.(5)K有多种同分异构体,满足下列条件的K的同分异构体还有18种.
①属于芳香族化合物 ②遇到FeCl3显紫色 ③可发生水解反应.
写出其中满足核磁共振氢谱图显示峰值比为1:2:2:2:1的同分异构体的结构简式
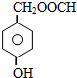 .
.
分析 I.A.由青蒿素分子结构可知,含有过氧键、酯基和醚键;
B.根据青蒿素的结构简式确定其分子式;
C.由双氢青蒿素转化为青蒿素是羟基转化为羰基;
D.由结构可知,双氢青蒿素含有3个六元环、1个七元环;
Ⅱ.D与丙酮发生信息①的反应生成E,N与E反应得到华法林,由N、华法林的结构简式,可推知E为 ,则D为
,则D为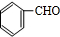 ,C为
,C为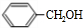 ,B为
,B为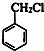 ,A为
,A为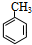 .F与甲醇发生酯化反应生成K为
.F与甲醇发生酯化反应生成K为 ,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N,据此解答.
,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N,据此解答.
解答 解:I.A.由青蒿素分子结构可知,含有过氧键、酯基和醚键,故A正确;
B.根据青蒿素的结构简式,确定其分子式为C15H22O5,故B正确;
C.由双氢青蒿素转化为青蒿素是羟基转化为羰基,属于氧化反应,故C正确;
D.由结构可知,双氢青蒿素含有3个六元环、1个七元环,故D错误,
故选:D;
Ⅱ.D与丙酮发生信息①的反应生成E,N与E反应得到华法林,由N、华法林的结构简式,可推知E为 ,则D为
,则D为 ,C为
,C为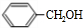 ,B为
,B为 ,A为
,A为 .F与甲醇发生酯化反应生成K为
.F与甲醇发生酯化反应生成K为 ,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N.
,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N.
(1)由上述分析可知,A为 ,名称是:甲苯,故答案为:甲苯;
,名称是:甲苯,故答案为:甲苯;
(2)C生成D发生醇的催化氧化,属于氧化反应,E与N合成华法林的反应类型是加成反应,
故答案为:氧化反应;加成反应;
(3)B→C发生卤代烃的水解反应,反应化学方程式是: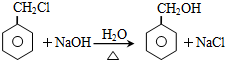 ,
,
故答案为: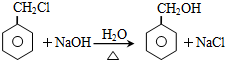 ;
;
(4)E的结构简式是 ,L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为
,L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 ,
,
故答案为: ;
; ;
;
(5)K( )有多种同分异构体,满足下列条件的K的同分异构体:
)有多种同分异构体,满足下列条件的K的同分异构体:
①属于芳香族化合物,含有苯环,②遇到FeCl3显紫色,说明含有酚羟基,③可发生水解反应,说明含有酯基,含有2各取代基,其中一个为-OH,另外的取代基为-OOCCH3、或者-COOCH3,或者-CH2OOCH各有邻、间、对3种(包含K在内),可以含有3个取代基,为-OH、-OOCH、-CH3,当-OH、-OOCH处于邻位时,-CH3有4种位置,当-OH、-OOCH处于间位时,-CH3有4种位置,当-OH、-OOCH处于对位时,-CH3有2种位置,故符合条件的同分异构体(除K外)有18种,其中满足核磁共振氢谱图显示峰值比为1:2:2:2:1的同分异构体的结构简式为: ,
,
故答案为:18; .
.
点评 本题考查有机物的推断与合成、官能团的结构与性质、有机方程式的书写,需要对给予的信息进行利用,较全面地考查学生的有机化学基础知识和逻辑思维能力,也有利于培养学生的自学能力和知识的迁移能力,题目难度中等.

(1)已知常温下,几种弱酸的电离常数如表:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②0.4mol•L-1的CH3COOH溶液与0.2mol•L-1的NaOH溶液等体积混合后,所得溶液中c(H+)>c(OH-)(填“>”“<”或“=”,下同)c(CH3COOH)<c(CH3COO-)
(2)工业生产中用可溶性的碳酸盐浸取石膏固体,写出浸取过程中发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-;已知常温时${K}_{sp}(CaC{O}_{3})=2.80×1{0}^{-9}$,${K}_{sp}(CaS{O}_{4})=4.9×1{0}^{-5}$,则此温度下该离子反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$
(3)雾霾袭城的日子越来越多,其中对雾霾“贡献”较大的物质之一是氮氧化物,CH4催化还原可消除氮氧化物的污染. 已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
现采集NO2与NO的体积比为1:3的样品,用标准状况下22.4L的CH4处理该样品,恰好完全反应(已知生成物全部为气态)并放出1042.8kJ的热量,则△H2=-1160kJ/mol.
| A. | 可用作荧光灯内壁保护层的氧化铝纳米材料属于胶体 | |
| B. | 高分子材料可能导电,如聚乙炔 | |
| C. | 钢化玻璃、有机玻璃、防弹玻璃均属于硅酸盐材料 | |
| D. | 人造刚玉的主要成分是MgO,熔点很高,可用作高级耐火材料 |
| A. | 食盐可以作为调味剂,也可以调节体液电解质平衡 | |
| B. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚乙烯 | |
| C. | 化工生产中煤的干馏、石油的分馏、天然气生产甲醇均属于化学变化 | |
| D. | 高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是BaSO4.
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2.
①支持甲同学观点的实验证据是液面上方略显浅棕色.
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式3Ba2++2NO3-+3SO2+2H2O=3BaSO4↓+2NO+4H+.
③乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
| 实验操作 | 实验现象 |
| 向2mL 0.1mol/LBaCl2 溶液(填化学式)中通入SO2 | 试管内有白色沉淀产生 |
| 实验操作 | 实验数据 |
| 向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 | 图1:向BaCl2(无氧)溶液中通入SO2 |
| 向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线. | 图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2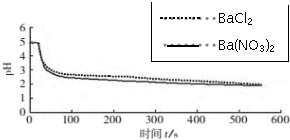 |
(4)图2,BaCl2溶液中发生反应的离子方程式为2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+.
(5)依据上述图象你得出的结论是在氧化SO2的过程中,O2起了主要作用.
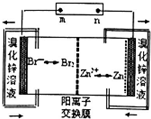
| A. | 充电时Zn2+通过阳离子交换膜由左侧流向右侧 | |
| B. | 放电时每转移2mol电子负极增重130g | |
| C. | 充电时阴极的电极反应式为Br2+2e-=2Br- | |
| D. | 若将电解液改为氯化锌溶液放电效果更好更安全 |